题目内容
5.下列物质转化在给定条件下能实现的是( )| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | NH3$\stackrel{O_{2}/催化剂}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
分析 A.氧化铝与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀;
B.硫单质与氧气反应生成的是二氧化硫;
C.氯化氢具有挥发性,蒸发氯化铁溶液得到的是氢氧化铁,若灼烧得到的是氧化铁,不会得到氯化铁;
D.氨气催化氧化生成的是NO,不是二氧化氮.
解答 解:A.氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠能够与二氧化碳反应生成氢氧化铝沉淀,所以转化关系Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3能够实现,故A正确;
B.S与氧气直接反应生成的是二氧化硫,不能直接转化成三氧化硫,故B错误;
C.加热FeCl3溶液,铁离子水解程度增大,由于氯化氢具有挥发性,则加热蒸干得到氢氧化铁或氧化铁,不会得到FeCl3,故C错误;
D.NH3与氧气反应生成的是NO,无法直接得到NO2,故D错误;
故选A.
点评 本题考查了常见金属及其化合物性质,题目难度中等,明确常见元素及其化合物性质为解答关键,试题侧重基础知识的考查,培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
15.下列有机物的命名正确的是( )
| A. | 3,4,4-三甲基己烷 | B. | 2-甲基-4-乙基-1-戊烯 | ||
| C. | 2-乙基-1-戊烯 | D. | 2-乙基丁烷 |
20.LiAlH4在125℃分解为LiH、H2和Al.下列说法中不正确的是( )
| A. | 乙醛在LiAlH4的作用下生成乙醇,LiAlH4作还原剂 | |
| B. | LiH中两种微粒半径:H->Li+ | |
| C. | 1mol LiAlH4在125℃完全分解,则转移4mol电子 | |
| D. | LiH溶于水的化学反应方程式:LiH+H2O═LiOH+H2↑ |
17.某实验小组以工业碳酸钙(含有少量NaCl、Al2O3、Fe2O3、SiO2等杂质,不考虑其他杂质)生产二水合氯化钙的主要流程如下:
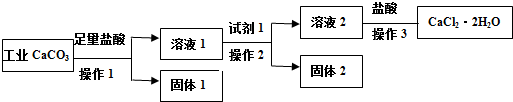
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
15.短周期非金属元素甲~戊在元素周期表中相对位置如下表所示,下列判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 原子核外电子层数:乙<丁 | |
| C. | 原子最外层电子数:丙>丁>戊 | |
| D. | 元素的最高价氧化物对应水化物的酸性:丙<戊 |
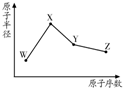 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强. ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);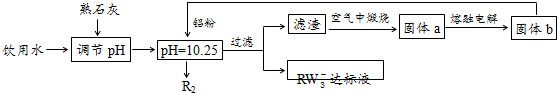
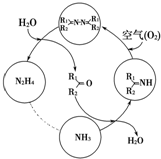 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).