题目内容
20.拆开1mol H-H键、1mol N-H键、1mol N≡N键需要的能量分别是436kJ、391kJ、946kJ,则1mol N2参加反应生成NH3的反应热为-92kJ•mol-1,2mol N2参加反应生成NH3的反应热为-184kJ•mol-1.分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;然后根据反应热与化学计量数成正比计算出2molH2参加反应生成NH3的反应热.
解答 解:在反应N2+3H2?2NH3中,断裂3molH-H键,1molN三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则1mol N2参加反应生成NH3的反应热为-92kJ•mol-1;
热化学方程式中,反应热与化学计量数成正比,则2mol N2参加反应生成NH3的反应热为:-92kJ•mol-1×2=-184kJ•mol-1,
故答案为:-92kJ•mol-1;-184kJ•mol-1.
点评 本题考查了反应热的计算,题目难度中等,明确反应热与反应物、生成物总键能的关系为解答关键,注意掌握化学反应与能力变化的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.鸡蛋壳的主要成分是碳酸钙,碳酸钙中钙的质量分数是( )
| A. | 25% | B. | 40% | C. | 50% | D. | 60% |
8.下列物质中,不能作为食品添加剂的是( )
| A. | 白醋 | B. | 白酒 | C. | 甲醇 | D. | 食盐 |
15.短周期非金属元素甲~戊在元素周期表中相对位置如下表所示,下列判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 原子核外电子层数:乙<丁 | |
| C. | 原子最外层电子数:丙>丁>戊 | |
| D. | 元素的最高价氧化物对应水化物的酸性:丙<戊 |
2.分子式与苯丙氨酸(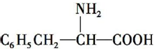 )相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
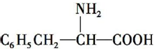 )相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )| A. | 3种 | B. | 6种 | C. | 8种 | D. | 10种 |
3.如表由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
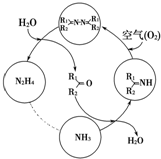 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).