题目内容
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学的知识回答:
表格中是不同温度下水的离子积数据:
试回答下列问题:
(1)若25<t1<t2,则α 1×10-14(填“>”“<”或“=”).
(2)25℃下,某HCl溶液中c(HCl)=1×10-4mol?L-1,则该溶液的PH= ,此时c(H+)= mol/L,加水稀释1000倍,则稀释后溶液中PH 7(填“>”“<”或“=”).
(3)t2℃下,将pH=11的氢氧化钠钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= .
表格中是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α
(2)25℃下,某HCl溶液中c(HCl)=1×10-4mol?L-1,则该溶液的PH=
(3)t2℃下,将pH=11的氢氧化钠钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
考点:水的电离,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)水的电离过程为吸热反应,温度升高,水的电离程度增大,据此进行判断α的大小;
(2)根据pH=-lgc(H+)计算出溶液的pH,氯化氢为强电解质,氢离子浓度等于氯化氢的浓度;溶液稀释1000倍后,溶液学生酸性溶液pH<7;
(3)t2℃下,水的离子积为1×10-12,混合液pH=2,溶液中氢离子浓度为0.01mol/L,根据氢氧化钠、稀硫酸的浓度、体积列式计算出V1:V2.
(2)根据pH=-lgc(H+)计算出溶液的pH,氯化氢为强电解质,氢离子浓度等于氯化氢的浓度;溶液稀释1000倍后,溶液学生酸性溶液pH<7;
(3)t2℃下,水的离子积为1×10-12,混合液pH=2,溶液中氢离子浓度为0.01mol/L,根据氢氧化钠、稀硫酸的浓度、体积列式计算出V1:V2.
解答:
解:(1)温度越高,水的电离程度越大,水的离子积越大,由于25<t1<t2,所以α>1×10-14,故答案为:>;
(2)25℃下,某HCl溶液中c(HCl)=1×10-4mol?L-1,则该溶液的pH=4,溶液中氢离子浓度为:1×10-4mol?L-1;加水稀释1000倍,则稀释后溶液还是酸性溶液,溶液的pH<7,
故答案为:4;1×10-4;<;
(3)t2℃下,水的离子积为1×10-12,将pH=11的氢氧化钠钠溶液中氢氧根离子浓度为0.01mol/L,pH=1的稀硫酸中氢离子浓度为0.1mol/L,所得混合溶液的pH=2,溶液中氢离子浓度为0.01mol/L,两溶液混合后,溶液中氢离子浓度为:
=0.01mol/L,解得 V1:V2=9:11,
故答案为:9:11.
(2)25℃下,某HCl溶液中c(HCl)=1×10-4mol?L-1,则该溶液的pH=4,溶液中氢离子浓度为:1×10-4mol?L-1;加水稀释1000倍,则稀释后溶液还是酸性溶液,溶液的pH<7,
故答案为:4;1×10-4;<;
(3)t2℃下,水的离子积为1×10-12,将pH=11的氢氧化钠钠溶液中氢氧根离子浓度为0.01mol/L,pH=1的稀硫酸中氢离子浓度为0.1mol/L,所得混合溶液的pH=2,溶液中氢离子浓度为0.01mol/L,两溶液混合后,溶液中氢离子浓度为:
| 0.1mol/L×V2-0.01mol/L×V1 |
| V1+V2 |
故答案为:9:11.
点评:本题考查了水的电离、溶液pH的简单计算,题目难度中等,注意明确水的电离为吸热反应,温度升高水的离子积增大;掌握溶液酸碱性与溶液pH的转化关系,试题(3)为易错点,注意该温度下的水的离子积.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
用NA表示阿伏伽德罗常熟的值,下列叙述中正确的是( )
| A、室温下,1mol乙烷含有的共价键数目为8NA |
| B、标准状况下,5.6L四氯化碳含有的分子数目为0.25NA |
| C、室温下,21.0g乙烯含有的碳原子数目为1.5NA |
| D、标准状况下,22.4L CH4与1mol甲基(-CH3)含有的电子数目均为10NA |
C3H6Cl2有四种结构,C3H2Cl6有( )种结构.
| A、2 | B、3 | C、4 | D、6 |
只能表示一个化学反应的离子方程式是( )
| A、HCO3-+OH -=H2O+CO32- |
| B、CO32-+2H+=H2O+CO2↑ |
| C、Fe+2H+=Fe2++H2↑ |
| D、Cl2+H2O=H++Cl -+HClO |

 的化合物称为二肽,二肽还可以继续与其它α-氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成
的化合物称为二肽,二肽还可以继续与其它α-氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成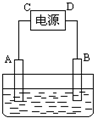 有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答:
有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答: