题目内容
A是一种含碳、氢、氧三种元素的有机化合物.已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应.通过计算求:
(1)A的分子式是 (写出计算过程),其结构简式是 .
(2)写出A与乙酸反应的化学方程式: .
(3)27.2g A在空气中充分燃烧时至少需要空气(标况下)多少L;生成的CO2用170ml 10mol/L的NaOH溶液吸收,反应后溶液中溶质的成分是什么,其物质的量各是多少?
(4)写出所有满足下列3个条件的A的同分异构体的结构简式:①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团.写出这些同分异构体的结构简式.
(1)A的分子式是
(2)写出A与乙酸反应的化学方程式:
(3)27.2g A在空气中充分燃烧时至少需要空气(标况下)多少L;生成的CO2用170ml 10mol/L的NaOH溶液吸收,反应后溶液中溶质的成分是什么,其物质的量各是多少?
(4)写出所有满足下列3个条件的A的同分异构体的结构简式:①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团.写出这些同分异构体的结构简式.
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)A中碳的质量分数为44.12%,氢的质量分数为8.82%,则A中氧的质量分数为:1-44.12%-8.82%=47.06%.由此可算出C:H:O≈5:12:4,分子式为C5H12O4,A只含有一种官能团,又能与乙酸发生酯化反应,该官能团必为羟基.但该羟基不能在两个相邻碳原子上发生消去反应,故邻位碳原子上应无氢原子,该分子中各原子已达到饱和,4个氧必为4个羟基,综上所述其结构为C(CH2OH)4;
(2)A中含有4个羟基,能够与乙发生酯化反应,根据酯化反应原理写出A和B反应的化学方程式;
(3)根据有机物A的燃烧通式计算出消耗氧气的物质的量,再根据空气中氧气的含量计算出需要空气的体积;根据A的物质的量计算出生成二氧化碳的物质的量,根据n=cV计算出氢氧化钠的物质的量,根据二氧化碳与氢氧化钠的物质的量之比判断反应后溶质的组成,再根据碳原子、钠原子守恒计算出各溶质的物质的量;
(4)根据同分异构体的书写方法、有机物A的分子式及题干条件写出出满足条件的有机物的结构简式.
(2)A中含有4个羟基,能够与乙发生酯化反应,根据酯化反应原理写出A和B反应的化学方程式;
(3)根据有机物A的燃烧通式计算出消耗氧气的物质的量,再根据空气中氧气的含量计算出需要空气的体积;根据A的物质的量计算出生成二氧化碳的物质的量,根据n=cV计算出氢氧化钠的物质的量,根据二氧化碳与氢氧化钠的物质的量之比判断反应后溶质的组成,再根据碳原子、钠原子守恒计算出各溶质的物质的量;
(4)根据同分异构体的书写方法、有机物A的分子式及题干条件写出出满足条件的有机物的结构简式.
解答:
解:(1)由于A中碳的质量分数为44.12%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.12%-8.82%=47.06%,
则C:H:O=
:
:
≈5:12:4,则分子式为C5H12O4;
A只含有一种官能团,又能与乙酸发生酯化反应,该官能团必为羟基,但该羟基不能在两个相邻碳原子上发生消去反应,故邻位碳原子上应无氢原子,又该分子中各原子已达到饱和,4个氧必为4个羟基,则该有机物的结构简式为:C(CH2OH)4,
故答案为:C5H12O4;C(CH2OH)4;
(2)A中含有4个-OH,1molA可与4mol乙酸完全发生酯化反应,反应的方程式为:C(CH2OH)4+4CH3COOH
C(CH2OOCCH3)4+4H2O,
故答案为:C(CH2OH)4+4CH3COOH
C(CH2OOCCH3)4+4H2O;
(3)27.2gA的物质的量为:
=0.2mol,根据燃烧通式C5H12O4+6O2
5CO2+6H2O可得,0.2mol该有机物A完全燃烧消耗氧气的物质的量为:0.2mol×6=1.2mol,标况下1.2mol氧气的体积为:22.4L/mol×1.2mol=26.88L,空气中氧气体积分数约为
,则需要标况下空气的体积为:26.88÷
=134.4L;
0.2molA完全燃烧生成二氧化碳的物质的量为:0.2mol×5=1mol,170ml 10mol/L的NaOH溶液中含有氢氧化钠的物质的量为1.7mol,二氧化碳与氢氧化钠的物质的量为1:1.7,则生成产物为Na2CO3、NaHCO3的混合物,设Na2CO3、NaHCO3的物质的量分别为x、y,根据碳原子、钠原子守恒可得:2x+y=1.7mol、x+y=1mol,解得:x=0.7mol、y=0.3mol,即混合物中含有0.7mol碳酸钠、0.3mol碳酸氢钠,
答:27.2g A在空气中充分燃烧时至少需要标况下的空气134.4L;反应后的溶质为Na2CO3、NaHCO3的混合物,混合物中含有0.7molNa2CO3、0.3molNaHCO3;
(4)A的分子式为C5H12O4,①属直链化合物,有机物分子中不含支链;②与A具有相同的官能团,分子中只含有羟基;③每个碳原子上最多只连一个官能团,同一个C原子上不会含有2个羟基,则满足以上条件的有机物的结构简式为:CH2OH(CHOH)3CH3、CH2OH(CHOH)2CH2CH2OH、CH2OHCHOHCH2CHOHCH2OH,
答:满足条件的A的同分异构体有:CH2OH(CHOH)3CH3、CH2OH(CHOH)2CH2CH2OH、CH2OHCHOHCH2CHOHCH2OH.
则C:H:O=
| 44.12% |
| 12 |
| 8.82% |
| 1 |
| 47.06% |
| 16 |
A只含有一种官能团,又能与乙酸发生酯化反应,该官能团必为羟基,但该羟基不能在两个相邻碳原子上发生消去反应,故邻位碳原子上应无氢原子,又该分子中各原子已达到饱和,4个氧必为4个羟基,则该有机物的结构简式为:C(CH2OH)4,
故答案为:C5H12O4;C(CH2OH)4;
(2)A中含有4个-OH,1molA可与4mol乙酸完全发生酯化反应,反应的方程式为:C(CH2OH)4+4CH3COOH
| 浓硫酸 |
| △ |
故答案为:C(CH2OH)4+4CH3COOH
| 浓硫酸 |
| △ |
(3)27.2gA的物质的量为:
| 27.2g |
| 136g/mol |
| 点燃 |
| 1 |
| 5 |
| 1 |
| 5 |
0.2molA完全燃烧生成二氧化碳的物质的量为:0.2mol×5=1mol,170ml 10mol/L的NaOH溶液中含有氢氧化钠的物质的量为1.7mol,二氧化碳与氢氧化钠的物质的量为1:1.7,则生成产物为Na2CO3、NaHCO3的混合物,设Na2CO3、NaHCO3的物质的量分别为x、y,根据碳原子、钠原子守恒可得:2x+y=1.7mol、x+y=1mol,解得:x=0.7mol、y=0.3mol,即混合物中含有0.7mol碳酸钠、0.3mol碳酸氢钠,
答:27.2g A在空气中充分燃烧时至少需要标况下的空气134.4L;反应后的溶质为Na2CO3、NaHCO3的混合物,混合物中含有0.7molNa2CO3、0.3molNaHCO3;
(4)A的分子式为C5H12O4,①属直链化合物,有机物分子中不含支链;②与A具有相同的官能团,分子中只含有羟基;③每个碳原子上最多只连一个官能团,同一个C原子上不会含有2个羟基,则满足以上条件的有机物的结构简式为:CH2OH(CHOH)3CH3、CH2OH(CHOH)2CH2CH2OH、CH2OHCHOHCH2CHOHCH2OH,
答:满足条件的A的同分异构体有:CH2OH(CHOH)3CH3、CH2OH(CHOH)2CH2CH2OH、CH2OHCHOHCH2CHOHCH2OH.
点评:本题考查了有机物分子式、结构简式的确定以及有机物官能团的结构与性质,题目难度中等,注意掌握确定有机物分子式的常用方法,(3)为易错点,注意结构简式的推断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列能达到实验目的是( )
A、 除去Fe(OH)3胶体中的FeCl3 |
B、 干燥、收集氨气,并吸收多余的氨气 |
C、 分离乙醇、乙酸 |
D、 除去杂质气体二氧化碳 |
下列叙述正确的是( )
| A、1H和3H的质子数相同,它们是同种核素 |
| B、6Li和7Li的质子数相等,电子数也相等 |
| C、14C和14N的质量数相等,它们的中子数相等 |
| D、13C和14C属于同一种元素,它们的质量数相等 |
已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCI+H20=HCl+HBrO,以下推论正确的是( )
| A、BrCl具有和卤素单质相似的化学性质 |
| B、BrCl和M反应时,BrCl即为氧化剂又为还原剂 |
| C、BrCl和NaOH溶液反应生成NaCI、NaBrO两种盐 |
| D、将BrCl跟FeS04溶液反应.溶液会变成无色 |
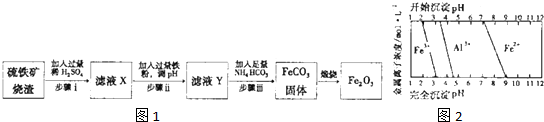
 铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.
铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.