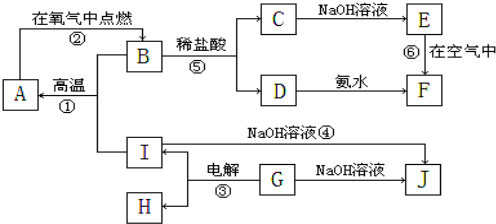
题目内容
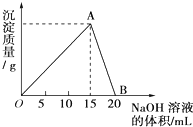 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:(1)图中A点表示的意义是
(2)OA段的化学方程式是
(3)AB段的离子方程式是
(4)当所得沉淀量为0.39g时,用去NaOH溶液的体积是
考点:离子方程式的有关计算,镁、铝的重要化合物
专题:计算题
分析:向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量,过程中发生的反应为①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O,图象中OA段为发生反应①,AB段为氢氧化铝溶解发生反应②,依据各步反应分析判断,进行有关计算,
解答:
解:(1)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,
故答案为:AlCl3与NaOH恰好完全反应,得到最大沉淀量;
(2)开始AlCl3与NaOH反应生成氢氧化铝沉淀和氯化钠,化学方程式是AlCl3+3NaOH=Al(OH)3↓+3NaCl;
故答案为:AlCl3+3NaOH=Al(OH)3↓+3NaCl;
(3)开始AlCl3与NaOH反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)0.39 g Al(OH)3的物质的量=
=0.005mol.
当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=
=0.0075L=7.5mL;
当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=
=0.0175L=17.5mL,
故答案为:7.5;17.5.
故答案为:AlCl3与NaOH恰好完全反应,得到最大沉淀量;
(2)开始AlCl3与NaOH反应生成氢氧化铝沉淀和氯化钠,化学方程式是AlCl3+3NaOH=Al(OH)3↓+3NaCl;
故答案为:AlCl3+3NaOH=Al(OH)3↓+3NaCl;
(3)开始AlCl3与NaOH反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)0.39 g Al(OH)3的物质的量=
| 0.39g |
| 78g/mol |
当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=
| 0.015mol |
| 2mol/L |
当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=
| 0.035mol |
| 2mol/L |
故答案为:7.5;17.5.
点评:本题是AlCl3与NaOH反应与图象相结合的计算问题,考查了大家对图象的解读能力,分析问题能力、计算能力等,难度中等,本题解决的关键是明确NaOH溶液逐滴加入到AlCl3溶液中的反应情况.

练习册系列答案
相关题目
已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCI+H20=HCl+HBrO,以下推论正确的是( )
| A、BrCl具有和卤素单质相似的化学性质 |
| B、BrCl和M反应时,BrCl即为氧化剂又为还原剂 |
| C、BrCl和NaOH溶液反应生成NaCI、NaBrO两种盐 |
| D、将BrCl跟FeS04溶液反应.溶液会变成无色 |
 铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.
铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.