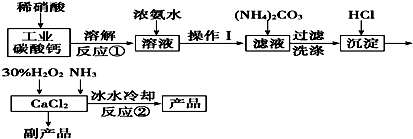
题目内容
20.科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:(1)用太阳能分解10mol水消耗的能量是2858kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
(3)在直接以甲醇为燃料的电池中,理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为96.6%(燃料电池的理论效率是指电池所产生的最大电能占燃料电池反应所能释放的全部能量的百分比).
分析 (1)由氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热化学方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)计算1mol甲醇反应放出的热量,进而计算该燃料电池的理论效率.
解答 解:(1)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)CH3OH(l)的燃烧热△H是-726.5kJ•mol-1,可知1mol甲醇反应放出的热量为725.6kJ,则该燃料电池的理论效率为$\frac{702.1kJ}{726.5kJ}$×100%=96.6%,
故答案为:96.6%.
点评 本题注重了对高考热点的考查,学生应熟悉燃烧热、盖斯定律、热化学反应方程式等重要知识,题目难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 硅是人类将太阳能转换为电能的常用材料 | |
| D. | 由粗硅制备单晶硅不涉及氧化还原 |
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口下沿处 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 能用CCl4从碘水中萃取碘是由于CCl4与H2O互不相溶且碘在CCl4中溶解度比在水中的大 |
| A. | H2O2的电子式: | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | S2-的结构示意图: | D. | CO2的比例模型: |
| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)滴定终点的现象:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是酸式滴定管用蒸馏水洗净后,应用标准液润洗
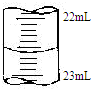
(5)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| A. | Fe 与S混合加热生成FeS | |
| B. | Fe与Cl2反应生成FeCl2 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | 氯气具有漂白性 |
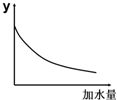
| A. | 溶液的pH | B. | 溶液的导电能力 | ||
| C. | 醋酸的电离平衡常数 | D. | 醋酸的c (OH-) |