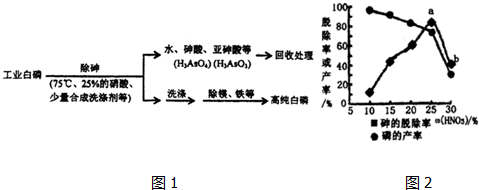
题目内容
5.短周期主族元素X、Y、Z、W的原子序数依次增大.X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构.下列说法正确的是( )| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故X为碳元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg;X、Y、Z、W原子的最外层电子数之和为18,则W最外层电子数为18-4-6-2=6,则W为S元素.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故X为碳元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg;X、Y、Z、W原子的最外层电子数之和为18,则W最外层电子数为18-4-6-2=6,则W为S元素.
A.Y和Z、W形成的化合物为MgO、SO2(或SO3),MgO中含有离子键,而SO2(或SO3)含有共价键,化学键类型不同,故A正确;
B.Mg单质为固体,而氧元素单质为氧气,故镁单质沸点更高,故B错误;
C.碳、盐、镁三种元素可能形成离子化合物,如碳酸镁、醋酸镁,故C错误;
D.X、W的最高价氧化物的水化物分别为碳酸、硫酸,碳酸属于弱酸,而硫酸属于强酸,故D错误.
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,明确物质结构、元素周期律即可解答,有利于基础知识的巩固.

练习册系列答案
相关题目
16.将4gNaOH固体溶于水配成100mL溶液,该溶液中NaOH的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 1mol/L | D. | 2mol/L |
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| B. | 18 g D2O中含有的质子数目为10 NA | |
| C. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
5.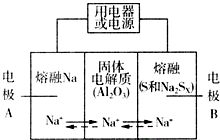 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
(1)根据上表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
 H2PO4-+H+.
H2PO4-+H+.