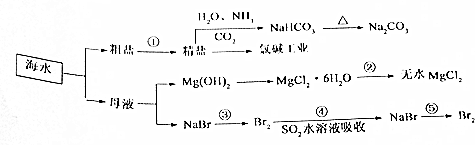
题目内容
4.下列操作过程中不能出现“先产生沉淀然后又完全溶解”现象的是( )①CaCl2液中通入CO2至过量
②澄淸石灰水通入SO2至过量
③氢氧化铁胶体中滴加稀硫酸至过量
④FeCl3溶液中逐滴加人氢氡化钠溶液至过量.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
分析 ①碳酸酸性弱于盐酸,向CaCl2溶液中通入过量CO2,无现象;
②向澄清石灰水中缓慢通入过量的SO2,先生成亚硫酸钙沉淀,然后亚硫酸钙与二氧化硫、水反应生成亚硫酸氢钙;
③向Fe(OH)3胶体中逐滴加入过量的稀硫酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后氢氧化铁又和硫酸反应生成可溶性的硫酸铁;
④反应生成氢氧化铁沉淀.
解答 解:①盐酸是强酸,碳酸是弱酸,所以碳酸不能制取盐酸,即二氧化碳和氯化钙不反应,最终没有沉淀析出,故①错误;
②向澄清石灰水中缓慢通入过量的SO2,先生成亚硫酸钙沉淀,然后亚硫酸钙与二氧化硫、水反应生成亚硫酸氢钙,白色沉淀溶解,故②正确;
③向Fe(OH)3胶体中逐滴加入过量的稀硫酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后氢氧化铁又和硫酸反应生成可溶性的硫酸铁,所以沉淀又溶解,故③正确;
④反应生成氢氧化铁沉淀,氢氧化铁沉淀与氢氧化钠不反应,故④错误.
故选C.
点评 本题考查较为综合,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,题目难度中等,解答本题的关键是把握物质的性质,注意有的物质之间发生反应时滴加顺序不同反应不同.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
17.NH3是一种重要的化工产品,是氮肥工业和制造硝酸、铵盐的重要原料: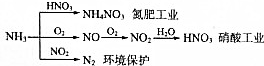
下列有关叙述错误的是( )
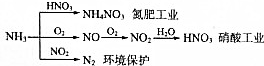
下列有关叙述错误的是( )
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
12.下列根据实验事实得出的结论错误的是( )
| 实验事实 | 结论 | |
| A | 加碱加热产生使湿润红色石蕊试纸变蓝的气体 | 溶液中含有NH4+ |
| B | 加BaCl2溶液有白色沉淀,加稀硝酸沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 加KSCN溶液无现象•再滴加氯水变血红 | 溶液中有Fe2+ |
| D | 加热时.铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
19.下列无色透明溶液中离子可以大量共存的是( )
| A. | H+、Na+、Cl-、ClO- | B. | K+、NO3-、Cl-、CO32- | ||
| C. | NH4+、Ca2+、OH-、HCO3- | D. | Al3+、NO3-、SO42-、MnO4- |
16.下列说法不正确的是( )
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
13.下列共价化合物中,分子中每个原子最外电子层都满足8电子结构的是( )
| A. | BF3 | B. | BeCl2 | C. | PC13 | D. | SO3 |
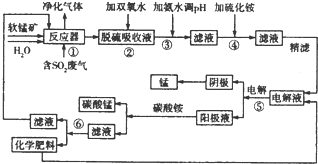
14.采用软锰矿浆(主要成分为Mn02,还含有Fe2O3、FeO、NiO、CoO等杂质)对工业烟气脱硫是工业生产中的一项新技术,该技术在脱硫的过程中还可以生产金属锰及化学肥料.该工艺流程如下图:
部分金属离子沉淀时的PH如下表:
回答下列问题:
(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,该反应的还原产物为亚铁离子、锰离子.
(2)写出步骤②中反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是后续得到有化学肥料中含有硫酸钠杂质.
(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是防止锰离子生成硫化锰沉淀.
(5)步骤⑤所用设备名称为电解槽.
(6)步骤⑥的化学肥料为硫酸铵,该肥料加入到步骤⑤中的作用是增加溶液的导电性.

部分金属离子沉淀时的PH如下表:
| 阳离子 | Fe2+ | Fe3+ | Mn2+ | Ni2+ | Co2+ | |
| 氢氧化物沉淀 | 开始沉淀的PH | 7.5 | 2.2 | 8.8 | 6.4 | 9.0 |
| 完全沉淀的PH | 9.5 | 3.5 | 10.8 | 8.4 | ||
| 硫化物沉淀 | 开始沉淀的PH | 6.2 | 4.67 | |||
| 完全沉淀的PH | ||||||
(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,该反应的还原产物为亚铁离子、锰离子.
(2)写出步骤②中反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是后续得到有化学肥料中含有硫酸钠杂质.
(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是防止锰离子生成硫化锰沉淀.
(5)步骤⑤所用设备名称为电解槽.
(6)步骤⑥的化学肥料为硫酸铵,该肥料加入到步骤⑤中的作用是增加溶液的导电性.