题目内容
下表为部分短周期元素化合价及相应原子半径的数据:
己知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池.
(1)F在周期表中位置是 ; 含1molC的氧化物晶体中含有的共价键数为: ;A的氢化物与少量H的最高价氧化物对应水化物的溶液反应生成的盐的电子式为: .
(2)E的简单气态氢化物极易溶于水的原因是: ;该氢化物与空气可以构成一种燃料电池,电解质溶液是稀硫酸,其负极的电极反应式为: ;
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是: .
(4)无色气体ED遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式 .
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | 0 |
(1)F在周期表中位置是
(2)E的简单气态氢化物极易溶于水的原因是:
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:
(4)无色气体ED遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式
考点:元素周期律的作用,微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:短周期元素,A、D的最低化合价-2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,D为O元素;
B、E都有最高正价+5、最低负价-3,处于ⅤA族,B的原子半径较大,则B为P元素、E为N元素;
C最高正价+4、最低负价-4,处于ⅣA族,原子半径较大,则C为Si元素;
F、G都有最低化合价-1,处于ⅦA族,G有最高正化合价+7,且原子半径较大,则F为F元素、G为Cl元素,
H最高正化合价为+1,原子半径大于Si,因此H为Na元素,以此来解答.
(1)F为F元素,在元素周期表中的位置是第二周期ⅤⅡA族;二氧化硅晶体,其中含有1molSi,每个Si形成四条Si-O,可形成4molSi-O;A的氢化物(H2S)与少量H的最高价氧化物对应水化物(NaOH)的溶液反应生成的盐(NaHS),NaHS为离子化合物;
(2)E的简单气态氢化物NH3极易溶于水的原因是NH3与H2O分子间形成氢键,增大了氨气的溶解度;由于是酸性电解质,氨气在负极失去电子生成氮气和氢离子;
(3)分子组成为ADG2的物质是SOCl2,在水中会强烈水解,产生使品红溶液褪色的无色气体是二氧化硫和一种强酸盐酸;
(4)无色气体ED遇空气变为红棕色,则该无色气体为NO,将标准状况下40LNO与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成硝酸钠、亚硝酸钠,根据N元素守恒和得失电子相等列式计算.
B、E都有最高正价+5、最低负价-3,处于ⅤA族,B的原子半径较大,则B为P元素、E为N元素;
C最高正价+4、最低负价-4,处于ⅣA族,原子半径较大,则C为Si元素;
F、G都有最低化合价-1,处于ⅦA族,G有最高正化合价+7,且原子半径较大,则F为F元素、G为Cl元素,
H最高正化合价为+1,原子半径大于Si,因此H为Na元素,以此来解答.
(1)F为F元素,在元素周期表中的位置是第二周期ⅤⅡA族;二氧化硅晶体,其中含有1molSi,每个Si形成四条Si-O,可形成4molSi-O;A的氢化物(H2S)与少量H的最高价氧化物对应水化物(NaOH)的溶液反应生成的盐(NaHS),NaHS为离子化合物;
(2)E的简单气态氢化物NH3极易溶于水的原因是NH3与H2O分子间形成氢键,增大了氨气的溶解度;由于是酸性电解质,氨气在负极失去电子生成氮气和氢离子;
(3)分子组成为ADG2的物质是SOCl2,在水中会强烈水解,产生使品红溶液褪色的无色气体是二氧化硫和一种强酸盐酸;
(4)无色气体ED遇空气变为红棕色,则该无色气体为NO,将标准状况下40LNO与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成硝酸钠、亚硝酸钠,根据N元素守恒和得失电子相等列式计算.
解答:
解:短周期元素,A、D的最低化合价-2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,D为O元素;
B、E都有最高正价+5、最低负价-3,处于ⅤA族,B的原子半径较大,则B为P元素、E为N元素;
C最高正价+4、最低负价-4,处于ⅣA族,原子半径较大,则C为Si元素;
F、G都有最低化合价-1,处于ⅦA族,G有最高正化合价+7,且原子半径较大,则F为F元素、G为Cl元素,
H最高正化合价为+1,原子半径大于Si,因此H为Na元素,以此来解答.
(1)F为F元素,在元素周期表中的位置是第二周期ⅤⅡA族;含1molC的氧化物晶体是二氧化硅晶体,其中含有1molSi,每个Si形成四条Si-O,可形成4molSi-O,因此共价键数为4NA;H2S与少量的NaOH溶液生成NaHS,NaHS为离子化合物,电子式为Na+ ;
;
故答案为:第二周期ⅤⅡA族;4NA;Na+ ;
;
(2)E的简单气态氢化物NH3极易溶于水的原因是NH3与H2O分子间形成氢键,增大了氨气的溶解度;由于是酸性电解质,氨气在负极失去电子生成氮气和氢离子,负极电极反应式为:2NH3-6e-=N2 +6H+,
故答案为:NH3与H2O分子间形成氢键;2NH3-6e-=N2 +6H+;
(3)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(4)无色气体ED遇空气变为红棕色,则该无色气体为NO,将标准状况下40LNO与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,生成硝酸钠、亚硝酸钠,令硝酸钠、亚硝酸钠的物质的量分别为xmol、ymol,则:
,解得x:y=1:3,故反应离子方程式为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
B、E都有最高正价+5、最低负价-3,处于ⅤA族,B的原子半径较大,则B为P元素、E为N元素;
C最高正价+4、最低负价-4,处于ⅣA族,原子半径较大,则C为Si元素;
F、G都有最低化合价-1,处于ⅦA族,G有最高正化合价+7,且原子半径较大,则F为F元素、G为Cl元素,
H最高正化合价为+1,原子半径大于Si,因此H为Na元素,以此来解答.
(1)F为F元素,在元素周期表中的位置是第二周期ⅤⅡA族;含1molC的氧化物晶体是二氧化硅晶体,其中含有1molSi,每个Si形成四条Si-O,可形成4molSi-O,因此共价键数为4NA;H2S与少量的NaOH溶液生成NaHS,NaHS为离子化合物,电子式为Na+
 ;
;故答案为:第二周期ⅤⅡA族;4NA;Na+
 ;
;(2)E的简单气态氢化物NH3极易溶于水的原因是NH3与H2O分子间形成氢键,增大了氨气的溶解度;由于是酸性电解质,氨气在负极失去电子生成氮气和氢离子,负极电极反应式为:2NH3-6e-=N2 +6H+,
故答案为:NH3与H2O分子间形成氢键;2NH3-6e-=N2 +6H+;
(3)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(4)无色气体ED遇空气变为红棕色,则该无色气体为NO,将标准状况下40LNO与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,生成硝酸钠、亚硝酸钠,令硝酸钠、亚硝酸钠的物质的量分别为xmol、ymol,则:
|
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
点评:本题考查性质结构位置关系应用,为高频考点,涉及电子式及化学方程式等常用化学用语、元素周期律、守恒思想的应用等,题目难度中等,注意利用化合价与半径确定元素是解题关键.

练习册系列答案
相关题目
钬的一种同位素
Ho可用于制作医疗激光器,其原子核内中子数与核外电子数之差是( )
165 67 |
| A、31 | B、67 | C、98 | D、165 |
容积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下反应N2+3H2?2NH3,达平衡时容积为V L,混合气体中氨气占总体积的20%,若压强温度不变,下列推论不正确的是( )
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
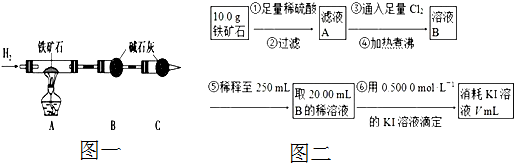
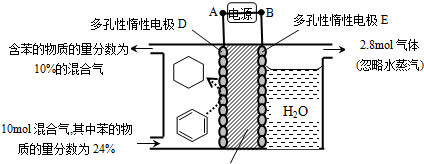
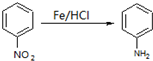
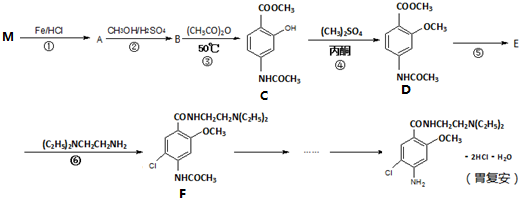
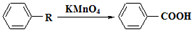 ,参照上述合成路线中的有关信息,写出由对甲苯酚为原料合成
,参照上述合成路线中的有关信息,写出由对甲苯酚为原料合成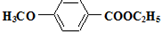 的合成流程图(其它试剂自选)
的合成流程图(其它试剂自选)