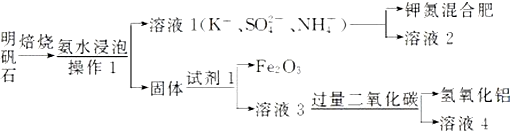
题目内容
7.现有一份由C、Al、Fe、Fe2O3、CuO中的几种物质组成的混合物粉末,某校化学课外小组取样品进行了如图实验(其中部分产物已略去):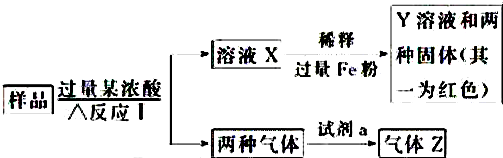
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成.取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)Al.
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
②若Z为两种气体的混合物,试剂a为适量H2O,则Z中两种气体的化学式是NO、CO2.
(3)向Y中通入过量Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)Cu2+、Fe3+、H+.
分析 能与Fe2O3、Fe、CuO、C、Al物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与Fe、C、Al单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2,Fe和Al被氧化为Fe3+和Al3+;如果是浓硝酸,则两种气体是CO2和NO2,其变化与加浓硫酸的反应相同.无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐,
(1)无论加什么浓酸(硫酸和硝酸),溶液X中都可能含有Fe3+、Cu2+、Al3+三种金属阳离子.向溶液X中加入过量的NaOH溶液,可转化为Fe(OH)3和Cu(OH)2沉淀析出,如果有Al3+,则可转化为AlO2-离子,如果上层清液,通入CO2后,会发生反应,产生白色沉淀Al(OH)3;
(2)①浓酸若为浓硫酸,其与样品中的C反应生成CO2和SO2,通入NaHCO3溶液后SO2被吸收,剩余CO2;
②浓酸若为浓硝酸,其与样品中的C反应生成CO2和NO2,通入水中后NO2转变为NO;
(3)X溶液中加过量Fe粉,得Y溶液和两种固体(其中一种固体为红色的Cu,另一种为过量的Fe粉),这个过程发生了置换反应:Cu2++Fe═Cu+Fe2+;再向Y溶液中通入过量Cl2,则会发生反应:Cl2+2Fe2+═2Cl-+2Fe3+、2Fe3++Cu═2Fe2++Cu2+、Cl2+H2O=HCl+HClO.
解答 解:(1)无论加什么浓酸(硫酸和硝酸),溶液X中都可能含有Fe3+、Cu2+、Al3+三种金属阳离子.向溶液X中加入过量的NaOH溶液,可转化为Fe(OH)3和Cu(OH)2沉淀析出,如果有Al3+,则可转化为ALO2-离子,如果上层清液,通入CO2后,会发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,产生白色沉淀Al(OH)3,这与“取上层清液,通入CO2,无明显变化”不相符,可以肯定溶液X中没有AlO2-,样品中没有Al,
故答案为:Al;
(2)①浓酸若为浓硫酸,其与样品中的C反应生成CO2和SO2,通入NaHCO3溶液后SO2被吸收,剩余CO2,反应I中能同时生成两种气体的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②浓酸若为浓硝酸,其与样品中的C反应生成CO2和NO2,通入水中后NO2转变为NO,气体Z为NO、CO2混合物,
故答案为:NO、CO2;
(3)向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉,这个过程发生了置换反应:Cu2++Fe=Cu+Fe2+,向Y溶液中通入过量氯气,并不断搅拌,会发生如下反应:Cl2+2Fe2+=2Cl-+2Fe3+,2Fe3++Cu=2Fe2++Cu2+,Cl2+H2O=HCl+HClO,充分反应后,溶液中的阳离子是:Cu2+、Fe3+、H+(特别注意没有了Fe2+),
故答案为:Cu2+、Fe3+、H+.
点评 本题考查无机推断,主要涉及金属单质、金属氧化物、非金属单质的性质,题目难度中等,试题综合性强,涉及知识面广,注意掌握浓硫酸、浓硝酸的性质,试题培养了学生的分析、理解能力及逻辑推理能力.

 名校课堂系列答案
名校课堂系列答案| A. | 将混合气体通过氢氧化钠溶液 | |
| B. | 使混合气体中的乙烯发生加聚反应 | |
| C. | 将混合气体在催化剂条件下跟氢气反应 | |
| D. | 将混合气体通过溴水 |
| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
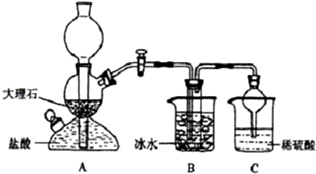
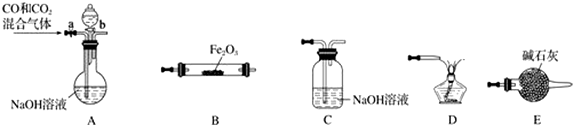
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液 的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚强 | |
| C. | 乙醇、乙醛和溴乙烷可以用银氨溶液鉴别 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
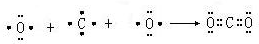
 .
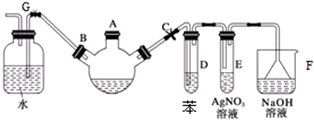
.
 .
.
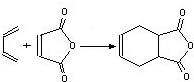
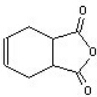 互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种.
互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种. ,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):
,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):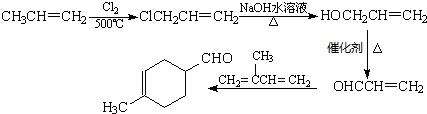 .
.