题目内容
12.分类是学习和研究化学的一种重要方法.下列分类不合理的是( )| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
分析 A.氧化物是指只含有两种元素,且其中一种元素是氧元素的化合物;
B.电离生成的阳离子全部是氢离子的化合物是酸;
C.电离生成的阴离子全部是氢氧根离子的化合物是碱;
D.能电离出金属阳离子(或铵根离子)和酸根离子的化合物是盐.
解答 解:A.Na2O和Na2O2都是只含有两种元素,且其中一种元素是氧元素的化合物,属于氧化物,故A不选;
B.H2SO4和CH3COOH是电离生成的阳离子全部是氢离子的化合物,属于酸,故B不选;
C.烧碱为氢氧化钠属于碱,纯碱为Na2CO3是由钠离子和碳酸根离子形成的化合物,属于盐,故C选;
D.Na2CO3是由钠离子和碳酸根离子形成的化合物,属于盐,NaHCO3是由钠离子和碳酸氢根离子形成的化合物,属于盐,故D不选;
故选C.
点评 本题考查了酸、碱、盐、氧化物的概念,题目难度不大,注意这几个概念的区别.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
3.通常用来衡量一个国家的石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 钢铁的产量 | D. | 硫酸的产量 |
17.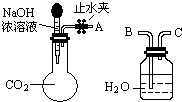 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
(3)在标况下,将4.48L CO2气体通入300mL 1mol/L 的NaOH的稀溶液中,写出该反应的离子方程式(用一个离子方程式表示)2CO2+3OH-=CO32-+HCO3-+H2O.
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
1.下列关于钢铁腐蚀与防护的说法正确的是( )
| A. | 钢铁的吸氧腐蚀和析氢腐蚀的正极反应式均为:Fe-2e-═Fe2+ | |
| B. | 钢铁发生吸氧腐蚀时,负极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 地下钢管连接镁块防腐的方法为“牺牲阳极的阴极保护法” | |
| D. | 钢铁发生吸氧腐蚀时,钢铁制品的质量一定减轻 |
20.龙胆酸甲酯(结构如图所示)是制备抗心律失常药物氟卡尼的中间体.正确的是( )
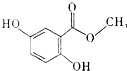

| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
 .
.
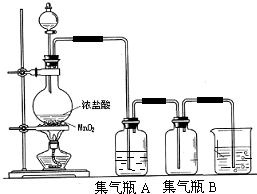 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取: