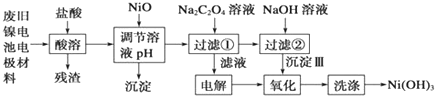
题目内容
2.明矾石的组成和明矾相似,是制取钾肥和氢氧化铝的重要原料,此外还含有氧化铝和少量的氧化铁杂质.具体实验流程如图: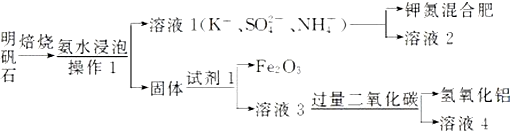
请回答下列问题:
(1)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl.
(2)操作1所用到的玻璃仪器的名称是漏斗、烧杯、玻璃棒.
(3)请你写出验证溶液1中有NH${\;}_{4}^{+}$的实验过程:取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+.
(4)由溶液3制取氢氧化铝的离子方程式为AlO2-+CO2+H2O=Al(OH)3+HCO3-.
(5)实验室用Fe2O3与CO反应来制取单质Fe.
①请按气流由左到右的方向连接下列各装置,顺序为A→E→B→C→D.
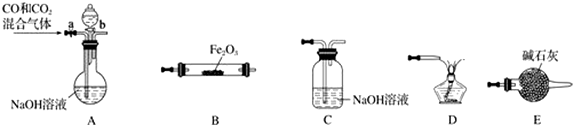
②检查装置A气密性的方法是关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好.
③在点燃B处的酒精灯前,应进行的操作是检验CO气体纯度.
④装置C的作用是除去CO气体混有的二氧化碳,利于CO点燃.
分析 (1)验证SO2气体具有还原性且实验现象明显可选用氯水、溴水、酸性高锰酸钾等有颜色的强氧化性试剂;
(2)将液体和不溶于液体的固体分离开来的操作是过滤;
(3)铵根离子与强碱反应,转化为氨气,氨气能使湿润的红色石蕊试纸变蓝;
(4)明矾石的组成和明矾相似,还含有氧化铝和少量的氧化铁杂质,可知固体为氢氧化铝、氧化铝、氧化铁.试剂1将铝元素转化到溶液3中,并将氧化铁除掉,所以试剂1为强碱,溶液3中含有偏铝酸根,通入二氧化碳,生成氢氧化铝沉淀;
(5)①A作用除去CO中混有的二氧化碳,B为Fe2O3与CO反应装置,C作用为吸收从B中出来的气体混有的二氧化碳,D作用为燃烧剩余的CO,E作用为干燥进入B装置的气体,据此连接装置;
②利用气体的热胀冷缩进行检验装置的气密性是否良好;
③CO为易燃气体,加热前需要检验其纯度;
④CO有毒,直接排放空气中,污染大气,通过燃烧方法转化为二氧化碳,从B中出来的气体含有二氧化碳,不利于CO点燃.
解答 解:(1)选用氯水检验时,氯气与SO2在溶液中反应生成盐酸和硫酸,反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(2)将液体和不溶的固体分离的操作方法为过滤,过滤操作用到的玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(3)验证溶液l中有NH4+的实验操作为:取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+,
故答案为:取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+;
(4)溶液3中含有偏铝酸根,通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢根离子,反应离子方程式为:AlO2-+CO2+H2O=Al(OH)3+HCO3-,
故答案为:AlO2-+CO2+H2O=Al(OH)3+HCO3-;
(5))①A作用除去CO中混有的二氧化碳,B为Fe2O3与CO反应装置,C作用为吸收从B中出来的气体混有的二氧化碳,D作用为燃烧剩余的CO,E作用为干燥进入B装置的气体,所以各装置顺序为:A→E→B→C→D,
故答案为:E→B→C→D;
②利用气体的热胀冷缩检验气密性,操作方法为:关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好,
故答案为:关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好;
③CO为易燃气体,不纯受热会发生爆炸危险,所以在加热前要检验其纯度,
故答案为:检验CO气体纯度;
④从B中出来的气体含有二氧化碳,不利于CO点燃,C装置作用为除去CO气体混有的二氧化碳,利于CO点燃,
故答案为:除去CO气体混有的二氧化碳,利于CO点燃.
点评 本题考查了物质分离与提纯方法的综合应用,题目难度中等,明确实验目的、实验原理为解答关键,注意熟练掌握化学实验基本操作方法,明确物质分离与提纯方法及其应用,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.

①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应.
| A. | 仅①②③④ | B. | 仅②③④ | C. | 仅①③⑤ | D. | 仅②④⑤ |
| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 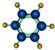 |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式
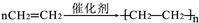 ;
;(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
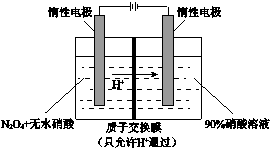 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.