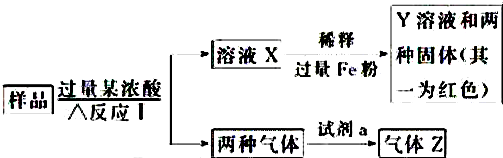
题目内容
17.短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D与B属于同一族元素.(1)元素:A为C,B为O,C为Na,D的质子数和中子数相等,D的原子组成符号为:${\;}_{16}^{32}$S,它的最高价氧化物对应的水化物为:H2SO4,其化学键属于共价键(“离子键”或“化学键”).
(2)用电子式表示A、B两元素形成AB2的过程:
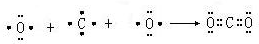
(3)用电子式表示C、D两元素形成化学键的过程:
 .
.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D与B属于同一族元素,则D为S元素,以此解答该题.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D与B属于同一族元素,则D为S元素,
(1)由以上分析可知,A为C,B为O,C为Na,D为S,质子数和中子数相等,则原子组成符号为${\;}_{16}^{32}$S,它的最高价氧化物对应的水化物为H2SO4,含有共价键,
故答案为:C;O;Na;${\;}_{16}^{32}$S;H2SO4;共价键;
(2)用电子式表示CO2的形成过程为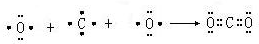 ,故答案为:
,故答案为: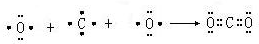 ;
;
(3)用电子式表示Na2S形成化学键的过程为 ,故答案为:
,故答案为: .
.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.1mol乙烯与Cl2完全加成,其产物再与Cl2彻底取代,两个过程中共用Cl2( )
| A. | 2mol | B. | 4mol | C. | 5mol | D. | 6mol |
5.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 78gNa2O2固体中含有阴离子的数目为2NA | |
| B. | 3.6g水含有极性键的数目为0.4NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
6.下列说法不正确的是( )
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“APEC蓝” |
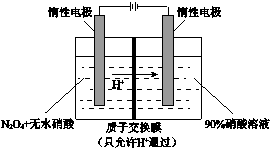 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义. .
.