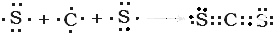题目内容
19.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和: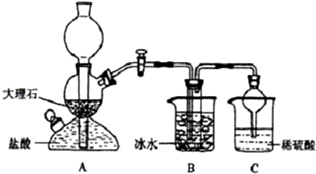
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液 的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
分析 由制备实验装置可知,A中发生CaCO3+2H+=Ca2++CO2↑+H2O,B中发生NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,为防止氨气与挥发的HCl反应,最好在A、B之间加盛有碳酸氢钠溶液的洗气瓶,结合溶解度可知,B中冷水冷却可析出NaHCO3,C中浓硫酸可吸收逸出的氨气,以此来解答.
(1)A装置是制取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;C装置稀硫酸是尾气处理装置吸收过量的氨气;
(2)温度越低越有利于碳酸氢钠的晶体析出;
(3)通入二氧化碳没有得到碳酸氢钠晶体,是二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
(4)依据化学方程式计算理论生成碳酸氢钠的质量,结合实际生成的碳酸氢钠的质量计算产率.
解答 解:由制备实验装置可知,A中发生CaCO3+2H+=Ca2++CO2↑+H2O,B中发生NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,为防止氨气与挥发的HCl反应,最好在A、B之间加盛有碳酸氢钠溶液的洗气瓶,结合溶解度可知,B中冷水冷却可析出NaHCO3,C中浓硫酸可吸收逸出的氨气.
(1)A装置中发生的反应是碳酸钙与盐酸反应生成二氧化碳和氯化钙、水,所发生反应的离子方程式为CaCO3+2H+=Ca2++CO2+H2O;因为该反应用到液氨,氨气易挥发,所以装置C中浓硫酸的作用是吸收从B装置中的试管内逸出的氨气,减少对环境的污染,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染;
(2)根据表中数据可知碳酸氢钠的溶解度随温度降低减小的较多,所以在冰水中有利于碳酸氢钠的析出,
故答案为:温度越低碳酸氢钠的溶解度越小,便于析出;
(3)二氧化碳的制取用到的盐酸易挥发出HCl,HCl若与氨气反应生成氯化铵,则反应中无碳酸氢钠生成,所以应除去二氧化碳中的HCl,在A与B之间加一个盛有碳酸氢钠饱和溶液的洗气瓶即可,
故答案为:AB;饱和碳酸氢钠溶液;除去二氧化碳气体中的氯化氢气体;
(4)5.85gNaCl的物质的量是0.1mol,若完全转化为碳酸氢钠,根据元素守恒,则生成碳酸氢钠的物质的量也是0.1mol,则碳酸氢钠的质量是0.1mol×84g/mol=8.4g,则碳酸氢钠的产率=$\frac{5.04g}{8.4g}$×100%=60%;
故答案为:60%.
点评 本题考查了侯氏制碱的反应原理和实验设计和操作,产率计算方法,流程中注意问题的分析是解题关键,题目难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
| A. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入氯水,氯水褪色后加热也能恢复原色 |

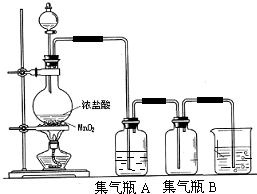 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取: 、用电子式表示CJ2的形成过程:
、用电子式表示CJ2的形成过程: