题目内容
9.1molCO2与足量Na2O2反应固体质量增重28g;1molH2O(g)与足量Na2O2反应固体质量增重2g;
2molNaHCO3受热充分分解,固体质量减轻62g.
分析 Na2O2和二氧化碳反应时,增重的是CO的质量;
Na2O2和水反应时,增重的是H2的质量;
根据NaHCO3受热分解的化学方程式可知,减轻的质量即是生成的二氧化碳和水的质量,据此分析.
解答 解:根据Na2O2和二氧化碳反应方程式2Na2O2+2CO2=2Na2CO3+O2可知,每当1mol二氧化碳参与反应时,增重的是1molCO的质量,即28g;
根据Na2O2和水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑可知,每当1mol水参与反应时,增重的是1molH2的质量,即2g;
根据NaHCO3受热分解的化学方程式2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O可知,当2mol碳酸氢钠受热分解时,减轻的质量即是生成的1mol二氧化碳和1mol水的质量,即△m=44g/mol×1mol+18g/mol×1mol=62g.
故答案为:28g;2g;62g.
点评 本题考查了过氧化钠和水、二氧化碳反应后固体的增重情况和碳酸氢钠受热分解导致的质量的减轻的有关计算,难度不大,掌握方程式的书写是解题关键.

练习册系列答案
相关题目
5.下列各组物质之间,一定是互为同系物的是( )
| A. | HCHO与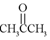 | B. | HOCH2CH3与CH3COOH | ||
| C. | HCOOH与C5H11COOH | D. | C2H4与C3H6 |
6.镁铁合金6.8g溶于300mL2mol/L的盐酸,在标准状况下放出气体的体积为5.6L,向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
| A. | 5.1g | B. | 10.2g | C. | 13.6g | D. | 15.3g |
4.下列有关物质性质排列顺序正确的是( )
| A. | 沸点:NH3>H2O>H2S | |
| B. | 酸性:H2SO4>HClO4>H3PO3 | |
| C. | 结合质子的能力:CO32->ClO->CH3COO- | |
| D. | 气态氢化物的热稳定性:H2O>HF>NH3 |
14.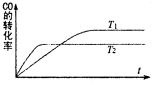 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )| A. | T1>T2,该反应的△H>0 | |
| B. | 加入催化剂可以提高CO的转化率 | |
| C. | T1时的平衡常数K1大于T2时的平衡常数K2 | |
| D. | 温度降低,CO(g)+2H2(g)?CH3OH(l)的△H值将变大 |
18.化学与生活息息相关,下列说法正确的是( )
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝”是指硝酸 |
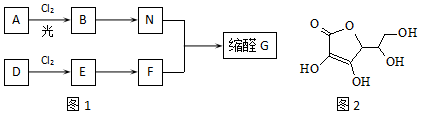
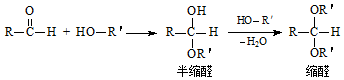
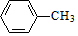 ,E的名称是1,2-二氯乙烷.
,E的名称是1,2-二氯乙烷.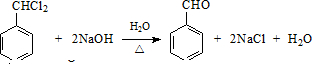 .
.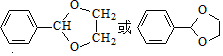 .G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:
.G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式: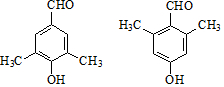 .
.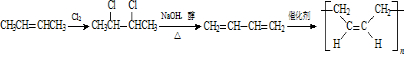 .
.