题目内容
5.下列各组物质之间,一定是互为同系物的是( )| A. | HCHO与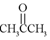 | B. | HOCH2CH3与CH3COOH | ||
| C. | HCOOH与C5H11COOH | D. | C2H4与C3H6 |
分析 结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物,同系物必须是同一类物质(含有相同且数量相等的官能团).
解答 解:A、HCHO是甲醛,属于醛类,而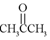 是丙酮,属于酮类,两者的官能团不同,结构不相似,故不是同系物,故A错误;
是丙酮,属于酮类,两者的官能团不同,结构不相似,故不是同系物,故A错误;
B、HOCH2CH3是乙醇,而CH3COOH是乙酸,两者的官能团不同,结构不相似,故不是同系物,故B错误;
C、HCOOH与C5H11COOH均属于羧酸类,结构相似,分子组成相差5个“CH2”原子团,故互为同系物,故C正确;
D、C2H4一定是乙烯,属于烯烃,但C3H6不一定是丙烯,还可能为环丙烷,故两者不一定是同系物,故D错误.
故选C.
点评 本题考查了同系物的判断,题目难度不大,注意掌握同系物的概念及判断方法,明确互为同系物的化合物一定满足结构相似,即含有的官能团类型及数目一定相同.

练习册系列答案
相关题目
16.下列关于硫及其化合物的说法正确的是( )
| A. | 浓硫酸滴入胆矾中,胆矾失水变白,发生了化学变化 | |
| B. | 二氧化硫能使溴水褪色,体现二氧化硫的漂白性 | |
| C. | 浓硫酸与灼热的木炭反应,体现浓硫酸的强氧化性和酸性 | |
| D. | 加热时硫与铜反应生成黑色的硫化铜 |
13.离子检验的设计要有三个环节,操作、现象和结论.下列离子的检验方法合理的是( )
| A. | 向某溶液中滴入盐酸,有无色无味的气体产生,说明某溶液一定含有含CO32- | |
| B. | 向某溶液中加入NaOH溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明某溶液中一定含有NH4+ | |
| C. | 向某溶液中滴加氯化钡溶液,得到白色沉淀,说明某溶液中一定含有SO42- | |
| D. | 向某溶液中加入过量的NaOH溶液的白色沉淀,又观察到颜色逐渐变为红褐色说明某溶液中一定含有Fe2+,一定不含有Al3+ |
20.在一定条件下,Na2CO3溶液中存在CO32-+H2O?HCO3-+OH-平衡,下列说法正确的是( )
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不变 | |
| B. | 通入CO2,溶液pH增大 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 |
10.我国城市环境中的大气污染物主要是( )
| A. | SO2、NO2、CO、烟尘 | B. | HCl、SO2、N2、粉尘 | C. | NH3、CO2、NO、雾 | D. | CO2、Cl2、O2、酸雨 |
17.下列有关物质用途的叙述不正确的是( )
| A. | 氧化铁可用作红色油漆和涂料 | B. | 氧化铝可制耐高温实验材料 | ||
| C. | 明矾可用作净水剂 | D. | 用铝制餐具长时间存放碱性食物 |
14.表为元素周期表的一部分.
回答下列问题:
(1)X元素在周期表中的位置为第三周期ⅣA族,表中元素原子半径最小的是氧元素(填元素名称).
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为NH3+HNO3=NH4NO3.
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是向试管中加入少量CS2并充分振荡(或向试管中加入少量NaOH溶液并加热).
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式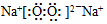 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.
(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式C(s)+2Cl2(g)=CCl4(l)△H=-687kJ/mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)X元素在周期表中的位置为第三周期ⅣA族,表中元素原子半径最小的是氧元素(填元素名称).
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为NH3+HNO3=NH4NO3.
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是向试管中加入少量CS2并充分振荡(或向试管中加入少量NaOH溶液并加热).
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式
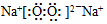 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式C(s)+2Cl2(g)=CCl4(l)△H=-687kJ/mol.