题目内容
17.氨气与氧化铜反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.请计算:(1)生成标准状况下的氮气1.12L消耗CuO的物质的量;
(2)3mol NH3和3mol CuO反应生成1mol N2,将过量的氨溶于生成的水成为氨水,计算该氨水中氨的质量分数(保留1位小数.
分析 (1)根根据n=$\frac{V}{{V}_{m}}$计算出氮气的物质的量,最高价反应方程式计算出消耗氧化铜的物质的量;
(2)根据方程式计算反应消耗的氨气和生成的水,然后计算剩余的氨气的质量,根据$\frac{m(N{H}_{3})}{m(N{H}_{3})+m({H}_{2}O)}$×100%计算.
解答 解:(1)已知3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,标准状况下1.12L氮气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,根据反应可知,生成0.05mol氮气消耗CuO的物质的量为:n(CuO)=3n(N2)=0.05mol×3=0.15mol,
答:生成标准状况下的氮气1.12L消耗CuO的物质的量为0.15mol;
(2)3mol NH3和3mol CuO反应生成1mol N2,由方程式可知反应消耗的氨气为2mol,则剩余的氨气为1mol,反应生成的水的物质的量为:n(H2O)=n(CuO)=3mol,
则剩余氨气的质量为:m=nM=1mol×17g/mol=17g,生成水的质量为:m(H2O)=nM=3mol×18g/mol=54g,
则该氨水中氨的质量分数为:$\frac{17g}{17g+54g}$×100%=23.9%,
答:该氨气中氨的质量分数为23.9%.
点评 本题考查有关方程式的计算,题目难度不大,注意根据反应方程式中物质的计量关系进行解答,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
13.离子检验的设计要有三个环节,操作、现象和结论.下列离子的检验方法合理的是( )
| A. | 向某溶液中滴入盐酸,有无色无味的气体产生,说明某溶液一定含有含CO32- | |
| B. | 向某溶液中加入NaOH溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明某溶液中一定含有NH4+ | |
| C. | 向某溶液中滴加氯化钡溶液,得到白色沉淀,说明某溶液中一定含有SO42- | |
| D. | 向某溶液中加入过量的NaOH溶液的白色沉淀,又观察到颜色逐渐变为红褐色说明某溶液中一定含有Fe2+,一定不含有Al3+ |
14.表为元素周期表的一部分.
回答下列问题:
(1)X元素在周期表中的位置为第三周期ⅣA族,表中元素原子半径最小的是氧元素(填元素名称).
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为NH3+HNO3=NH4NO3.
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是向试管中加入少量CS2并充分振荡(或向试管中加入少量NaOH溶液并加热).
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式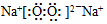 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.
(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式C(s)+2Cl2(g)=CCl4(l)△H=-687kJ/mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)X元素在周期表中的位置为第三周期ⅣA族,表中元素原子半径最小的是氧元素(填元素名称).
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为NH3+HNO3=NH4NO3.
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是向试管中加入少量CS2并充分振荡(或向试管中加入少量NaOH溶液并加热).
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式
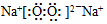 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式C(s)+2Cl2(g)=CCl4(l)△H=-687kJ/mol.
7.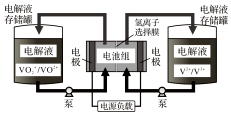 全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )
 全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )| A. | 放电时,正极电极反应为:VO2++e-+2H+=VO2++H2O | |
| B. | 充电时,阴极电极反应为:V3++e-=V2+ | |
| C. | 放电时,H+从电池右边移向左边 | |
| D. | 利用该电池电解饱和NaCl溶液(石墨作电极),2 mol VO2+发生氧化反应时,可生成气体44.8 L |
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
