题目内容
8.已知A、B、D、E间的转化关系如图所示:
请回答下列问题.
(1)写出下列物质的化学式:
ACu,BCuCl2,ECuO.
(2)写出下列反应的化学方程式:
①C→DCuCl2+2NaOH=Cu(OH)2↓+2NaCl.
②E→CCuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
分析 单质A与氯气反应生成棕黄色的烟,且溶于水变为蓝色溶液,可知A为Cu,B为CuCl2,C为CuCl2的溶液,蓝色沉淀D为Cu(OH)2,黑色固体E为CuO,结合对应物质的性质以及题目要求解答该题.
解答 解:单质A与氯气反应生成棕黄色的烟,且溶于水变为蓝色溶液,可知A为Cu,B为CuCl2,C为CuCl2的溶液,蓝色沉淀D为Cu(OH)2,黑色固体E为CuO,
(1)由以上分析可知A为Cu,B为CuCl2,E为CuO,故答案为:Cu;CuCl2;CuO;
(2)氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,反应的化学方程式为CuCl2+2NaOH=Cu(OH)2↓+2NaCl,
CuO和氢气在加热条件下反应生成铜和水,方程式为CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,
故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握物质的性质以及转化的现象,难度不大.

练习册系列答案
相关题目
18.“绿色化学”特点之一是:提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”.以下反应不符合绿色化学原子经济性要求的是( )
| A. | 乙烯在银作催化剂的条件下与氧气反应生成环氧乙烷 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 乙烯与氯化氢加成制氯乙烷 | |
| D. | 利用乙烯与氢气加成制得的乙烷与氯气在光照条件下制氯乙烷 |
19.根据如图提供的信息,下列所得结论正确的是( )
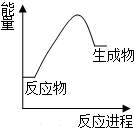

| A. | 生成物比反应物稳定 | |
| B. | 该反应的△H<0 | |
| C. | 该图可以表示石灰石高温分解反应 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定不能发生 |
16.在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体.
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液, 振荡,观察; | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸 再加入少许AgNO3溶液振荡,观察. | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
3.下列有关实验的操作和设计正确的是( )
| A. | 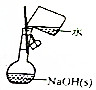 配制0.10mol•L-1的NaOH溶液 配制0.10mol•L-1的NaOH溶液 | |
| B. | 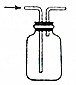 在实验室中用排空气法收集CO2 在实验室中用排空气法收集CO2 | |
| C. | 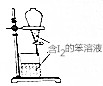 用苯萃取碘水中的碘,分出水层后的操作 用苯萃取碘水中的碘,分出水层后的操作 | |
| D. | 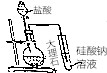 比较Cl,C,Si三种元素的非金属性强弱 比较Cl,C,Si三种元素的非金属性强弱 |
11.某实验小组进行了“影响化学反应速率”的探究实验,原始数据记录如下:
(1)比较三组数据,初步得出的结论是:当其他条件不变时,H2SO4(填化学式)的浓度增加,反应速率加快(填“加快”、“减慢”或“不变”); 对比①、②两组实验,你认为影响反应速率的因素是固体接触面积.
(2)写出该反应的离子方程式Zn+2H+═Zn2++H2↑,
(3)经过试验对比,同学们在①组试验的试管中,滴入几滴CuSO4溶液后,锌粒表面有紫红色物质生成,同时发现试管中产生气泡的速度明显加快,请你分析,产生这种现象加快反应速率的原因是因为发生了原电池反应.
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
(2)写出该反应的离子方程式Zn+2H+═Zn2++H2↑,
(3)经过试验对比,同学们在①组试验的试管中,滴入几滴CuSO4溶液后,锌粒表面有紫红色物质生成,同时发现试管中产生气泡的速度明显加快,请你分析,产生这种现象加快反应速率的原因是因为发生了原电池反应.
9.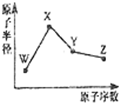 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 对应简单离子半径:W>X | |
| B. | 对应气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW既含离子键,又含极性共价键 | |
| D. | Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应 |
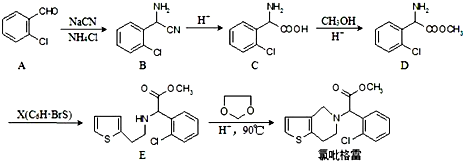
 ,
, ;
;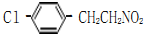 、
、 、
、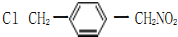
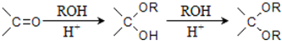
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).