题目内容
3.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图:
根据上述实验,以下说法正确的是( )
| A. | 由现象1和现象3推测溶液甲中一定含有K2SiO3、NaNO2 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 无法判断原混合物中是否含有KAlO2、K2CO3、MgCl2 | |
| D. | 根据现象5推测原混合物中一定含有Fe2O3 |
分析 有色气体A应为NO2,可能含有CO2气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,以此解答该题.
解答 解:有色气体A应为NO2,可能含有CO2、SO2等气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,
A.由以上分析可知一定含有K2SiO3、NaNO2,故A正确;
B.因含有NaNO2,如含有K2SO3,二者在酸性条件下发生氧化还原反应生成SO42-,加入氯化钡生成硫酸钡沉淀,加入足量稀盐酸后再加入BaCl2溶液没有沉淀,则一定不含有K2SO3,故B错误;
C.含有K2SiO3,则一定不含有MgCl2,故C错误;
D.溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,故D错误.
故选A.
点评 本题考查无机物的推断,涉及物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为B和D,注意体会.

练习册系列答案
相关题目
13.在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
表中V2=40mL,该实验的目的是实验目的是探究温度、亚硫酸钠溶液浓度与该反应速率的关系.
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
14.从人类利用金属的历史看,先是青铜器时代,后是铁器时代,而铝的利用只是近百年的事,造成这个先后顺序事实的最主要因素是( )
| A. | 金属的导电性 | B. | 金属的延展性 | ||
| C. | 地壳中金属元素的含量 | D. | 金属冶炼的难易程度 |
18.下列各组物质性质的排列顺序不正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 稳定性:HF>H2O>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 熔沸点:Rb>K>Na>Li |
8.五种元素X、Y、Z、W、M在周期表中位置关系如表,其中X、Y、Z、W是短周期元素,Z的气态氢化物与其低价氧化物能反应生成该元素单质的元素.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |
15.在以稀硫酸为电解质溶液的碳--铁原电池中,已知其电极反应分别为
铁片:Fe-2e-═Fe2+; 碳棒:2H++2e-═H2↑
下列判断正确的是( )
铁片:Fe-2e-═Fe2+; 碳棒:2H++2e-═H2↑
下列判断正确的是( )
| A. | 溶液的酸性逐渐增强 | B. | 碳棒逐渐溶解 | ||
| C. | 溶液中H+向铁片作定向移动 | D. | 铁片是负极并被氧化 |
12.下列有机物分子中,属于正四面体构型的是( )
| A. | 乙烯 | B. | 乙炔 | C. | 苯 | D. | 四氯化碳 |
14.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$\stackrel{催化剂}{?}$2N2(g)+3H2O(g)△H<0.在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,增加NH3的浓度,反应速率会降低 | |
| B. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 | |
| C. | 其他条件不变,充入氦气,压强增大,化学反应速率增大 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
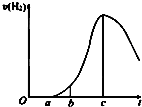 成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.