题目内容
18.下列各组物质性质的排列顺序不正确的是( )| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 稳定性:HF>H2O>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 熔沸点:Rb>K>Na>Li |
分析 A.非金属性越强,最高价氧化物对应水合物的酸性越强;
B.非金属性越强,氢化物的稳定性越强;
C.金属性越强,最高价氧化物对应水合物的碱性越强;
D.随着原子序数的递增,碱金属单质的沸点逐渐降低.
解答 解:A.同一周期中,原子序数越大,非金属性越强,则非金属性Cl>S>P>Si,则最高价含氧酸的酸性:HClO4>H2SO4>H3PO4>H2SiO3,故A正确;
B.同一周期中,原子序数越大,非金属性越强,则非金属性F>O>S,则氢化物稳定性HF>H2O>H2S,故B正确;
C.金属性K>Na>Mg,则最高价氧化物对应水合物的碱性:KOH>NaOH>Mg(OH)2,故C正确;
D.原子序数越大,碱金属单质的沸点越低,则熔沸点:Rb<K<Na<Li,故D错误;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
8.分子里所有原子都在同一平面上的是( )
| A. | 甲烷、乙烯、乙炔 | B. | 乙烯、苯、乙炔 | C. | 乙醇、乙醛、乙酸 | D. | 乙烯、苯、甲苯 |
9.某元素的一种同位素X的原子质量数为A,含N个中子,X的最高价氧化物为XO3,则在a g X的气态氢化物中所含质子的物质的量是( )
| A. | $\frac{a}{A+3}$(A-N+3)mol | B. | $\frac{a}{A}$(A-N)mol | C. | $\frac{a}{A+2}$(A-N+2)mol | D. | $\frac{a}{A+3}$(A-N)mol |
6.下列能源中属于二次能源的是( )
| A. | 流水 | B. | 风力 | C. | 原煤 | D. | 电力 |
13.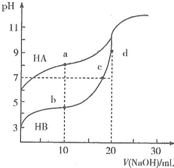 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mo1•L-1的HA溶液和HB溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | HA的酸性强于HB | B. | d点溶液中:c(Na+)>c(OH-)>c(B-)>c(H+) | ||
| C. | a和b点溶液中:c(B-)<c(A-) | D. | b点溶液中:c(B-)+2c(OH)-=c(HB)+2c(H+) |
3.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图:

根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A. | 由现象1和现象3推测溶液甲中一定含有K2SiO3、NaNO2 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 无法判断原混合物中是否含有KAlO2、K2CO3、MgCl2 | |
| D. | 根据现象5推测原混合物中一定含有Fe2O3 |
10.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
请回答:
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是等于.
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组情况分析,HA是强酸还是弱酸弱酸(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(3)②组情况表明,c大于0.2mol/L(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是等于.
(4)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
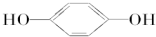 E;
E;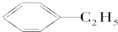 H;
H; 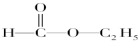 I;
I;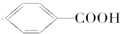 G;
G; 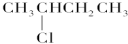 J.
J.