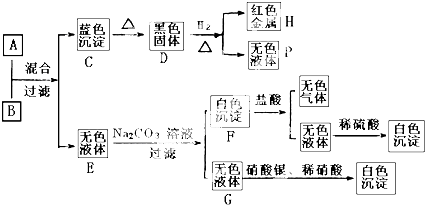
题目内容
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、22.4 L甲烷(CH4)所含的原子数为5NA |
| C、0.5 molCuO的摩尔质量为40g/mol |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3NA |
考点:阿伏加德罗常数
专题:
分析:A、根据n=
计算出氮气的物质的量及含有的原子数;
B、分析气体摩尔体积的应用条件;
C、CuO的摩尔质量为80g/mol.
D、根据n=CV并结合K2SO4的分子式来分析.
| m |
| M |
B、分析气体摩尔体积的应用条件;
C、CuO的摩尔质量为80g/mol.
D、根据n=CV并结合K2SO4的分子式来分析.
解答:
解:A、28g氮气的物质的量为1mol,含有2mol氮原子,28g氮气所含的原子数为2NA,故A正确;
B、温度压强未定,22.4L甲烷不一定是1mol,故B错误;
C、CuO的摩尔质量为80g/mol,0.5 molCuO的质量为40g,故C错误;
D、K2SO4的物质的量n=CV=1mol/L×2L=2mol,而1molK2SO4含3mol离子,故2molK2SO4含6mol离子,故D错误.
故选A.
B、温度压强未定,22.4L甲烷不一定是1mol,故B错误;
C、CuO的摩尔质量为80g/mol,0.5 molCuO的质量为40g,故C错误;
D、K2SO4的物质的量n=CV=1mol/L×2L=2mol,而1molK2SO4含3mol离子,故2molK2SO4含6mol离子,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
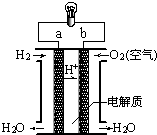

| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
下列各组中的两种物质作用时,反应条件或反应物用量改变时,对生成物没有影响的是( )
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
下列两种物质中含有的氧原子数不同的是( )
| A、质量比为2:1的SO2和O2 |
| B、9g水和22gCO2 |
| C、12gNO和9.8gH2SO4 |
| D、物质的量相同的H2SO4和H3PO4 |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和 |
| B、常温常压下1mol NO2气体与水反应生成NA个NO3-离子 |
| C、121g CCl2F2所含的氯原子数为2NA |
| D、62g Na2O溶于水后所得溶液中含有O2-离子数为NA |
下列说法中不正确的是( )
| A、物质的量是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B、摩尔是国际单位制中七个基本物理量之一 |
| C、1mol任何微观粒子的质量以克为单位,数值上等于该粒子的相对原子(分子)质量 |
| D、含有6.02×1023个粒子的任何微观粒子集体计量为1摩尔 |
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |