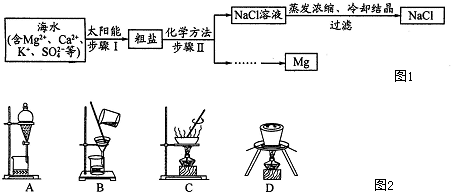
题目内容
下列叙述正确的是( )
| A、Na2SO3溶液中通入CO2溶液变浑浊,继续通入CO2至过量,浑浊消失 |
| B、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2( SO4)3、Fe Cl3、Fe2( SO4)3 |
| C、Na、Mg、Cl是海水中的重要元素,从海水中制备这三种元素单质的反应都定存在氧化还原反应 |
D、元素X的单质及元素X与Y形成的化合物能按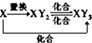 关系发生转化,则X可为Fe或S 关系发生转化,则X可为Fe或S |
考点:钠的重要化合物,氧化还原反应,盐类水解的原理
专题:
分析:A.根据硅酸的酸性比碳酸弱判断;
B.由于硫酸难挥发,所以Fe2(SO4)3溶液蒸干后得到的仍然是Fe2(SO4)3;
C.氧化还原反应判断的依据是:有化合价的变化;
D.将Fe或S代入验证.
B.由于硫酸难挥发,所以Fe2(SO4)3溶液蒸干后得到的仍然是Fe2(SO4)3;
C.氧化还原反应判断的依据是:有化合价的变化;
D.将Fe或S代入验证.
解答:
解:A.因为硅酸的酸性比碳酸弱,所以向硅酸钠溶液中通入CO2会生成硅酸浑浊和Na2CO3,继续通入CO2,Na2CO3转化为NaHCO3,但浑浊不消失,A错误;
B.由于硫酸难挥发,所以Fe2(SO4)3溶液蒸干后得到的仍然是Fe2(SO4)3,B项错误;
C.Na、Mg、Al为活泼金属在海水中以离子的形式存在化合价均为正值,转化成单质后,化合价变为0价,属于氧化还原反应,故C正确;
D.X可为Fe元素但不能为S元素,S不能一步化合生成三氧化硫,D错误.
故选:C.
B.由于硫酸难挥发,所以Fe2(SO4)3溶液蒸干后得到的仍然是Fe2(SO4)3,B项错误;
C.Na、Mg、Al为活泼金属在海水中以离子的形式存在化合价均为正值,转化成单质后,化合价变为0价,属于氧化还原反应,故C正确;
D.X可为Fe元素但不能为S元素,S不能一步化合生成三氧化硫,D错误.
故选:C.
点评:本题考查元素及其化合物的知识,意在考查考生对知识的整合和综合运用能力,难度一般.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g.则下列叙述不正确是( )
| A、当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B、当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C、原稀硝酸的物质的量浓度一定为4mol/L |
| D、参加反应金属总质量(m)为9.6g>m>3.6g |
人体血液中存在的平衡:H2CO3?H++HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随 变化关系如表所示,则下列说法中错误的是( )
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )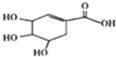

| A、分子式为C7H10O5 |
| B、1mol莽草酸与足量金属钠反应生成2molH2 |
| C、可发生加成反应、取代反应、氧化反应 |
| D、在水溶液中羧基和羟基均能电离出H+ |
下列反应所得溶液中只含一种溶质的是( )
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
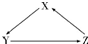 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )