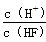��Ŀ����
�Ӻ�ˮ����ȡ�Լ���NaCl�����ս���Mg�Ĺ�ҵ������ͼ1��
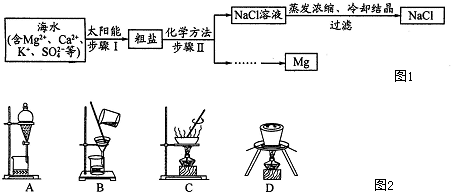
��1������Iԭ����ͼ2����ʵ��������ɸò�������װ��Ϊ ������ţ���
��2��ijѧϰС�������ʵ��ģ�ⲽ���
�����ܽ�
����
NaCl��Һ
�ٸ�ʵ���м���Na2CO3�������� �����������Һ�м������Na2CO3Ũ��Һ���������ܵ�Mg2��OH��2C03���ɣ�ͬʱ�������ݳ����÷�Ӧ�����ӷ���ʽΪ ��
��ѧϰС�鷢������ʵ�鼴ʹBaCl2�������㣬�ڢ۲���������Ȼ��������BaCO3���Դ�ƽ��Ƕȷ��� ��
���ڵڢڲ������ӹ��ˣ����������еõ�MgCl2?6H2O����ҵ��ͨ�������Mg�Ļ�ѧ����ʽΪ ��
��720��ʱֱ�ӽ�MgCl2.6H20���ڣ�Ȼ���ö��Ե缫��⣬�����й���ʣ�࣬��ù�������� ��д��ѧʽ��������ag���������϶���������������Mgʱ���������Cl2bL��ʣ�����Ϊcg����������þԪ�ص���������Ϊ �����ػ���

��1������Iԭ����ͼ2����ʵ��������ɸò�������װ��Ϊ
��2��ijѧϰС�������ʵ��ģ�ⲽ���
�����ܽ�
| Bacl2 |
| �� |
| NaOH |
| �� |
| Na2CO3 |
| �� |
| HCl |
�ٸ�ʵ���м���Na2CO3��������
��ѧϰС�鷢������ʵ�鼴ʹBaCl2�������㣬�ڢ۲���������Ȼ��������BaCO3���Դ�ƽ��Ƕȷ���
���ڵڢڲ������ӹ��ˣ����������еõ�MgCl2?6H2O����ҵ��ͨ�������Mg�Ļ�ѧ����ʽΪ
��720��ʱֱ�ӽ�MgCl2.6H20���ڣ�Ȼ���ö��Ե缫��⣬�����й���ʣ�࣬��ù��������
���㣺���ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ��,��ˮ��Դ�����ۺ�����
ר�⣺
�������ɷ������̿�֪������I����̫���ܽ��к�ˮɹ�Σ�������ԭ����ͬ�������Ϊ�����ܽ�
����
NaCl��Һ���ٳ�ȥ��������ӣ��ڳ�ȥþ���ӣ��۳�ȥ�����Ӽ������ı����ӣ���������ɳ�ȥ������̼���ƣ�ע������Լ����������Դ������
| BaCl2 |
| �� |
| NaOH |
| �� |
| Na2CO3 |
| �� |
| HCl |
���
�⣺��1������Iԭ��Ϊ��������ʵ��������ɸò�������װ��Ϊͼ2��C�����������ʴ�Ϊ��C��
��2���ٸ�ʵ���м���Na2CO3�������dz�ȥ�����ӡ������ӣ����������Һ�м������Na2CO3Ũ��Һ���������ܵ�Mg2��OH��2C03���ɣ�ͬʱ�������ݳ�������ΪC02���÷�Ӧ�����ӷ���ʽΪ2CO32-+2Mg2++H2O=Mg2��OH��2C03��+C02����
�ʴ�Ϊ����ȥ�����ӡ������ӣ�2CO32-+2Mg2++H2O=Mg2��OH��2C03��+C02����
�ڵڢ۲���������Ȼ��������BaCO3������Ϊ����CO32-ʹBaSO4���ܽ�ƽ�����ܽⷽ���ƶ����Ӷ��γ�BaCO3���ʴ�Ϊ������CO32-ʹBaSO4���ܽ�ƽ�����ܽⷽ���ƶ����Ӷ��γ�BaCO3��
��MgΪ���ý�������ҵ��ͨ�������Mg�Ļ�ѧ����ʽΪMgCl2�����ڣ�
Mg+Cl2����720��ʱֱ�ӽ�MgCl2.6H20���ڣ�ˮ������Mg��OH��2��Ȼ��ֽ����ɹ���MgO�������к�MgCl2?6H2O�����������Cl2bL����MgCl2�����ڣ�
Mg+Cl2����֪��MgΪ
��24g/mol=
g��ʣ�����ΪcgΪMgO����������MgΪ
g����������þԪ�ص���������Ϊ
��100%��
�ʴ�Ϊ��MgCl2�����ڣ�
Mg+Cl2����
��100%��
��2���ٸ�ʵ���м���Na2CO3�������dz�ȥ�����ӡ������ӣ����������Һ�м������Na2CO3Ũ��Һ���������ܵ�Mg2��OH��2C03���ɣ�ͬʱ�������ݳ�������ΪC02���÷�Ӧ�����ӷ���ʽΪ2CO32-+2Mg2++H2O=Mg2��OH��2C03��+C02����
�ʴ�Ϊ����ȥ�����ӡ������ӣ�2CO32-+2Mg2++H2O=Mg2��OH��2C03��+C02����
�ڵڢ۲���������Ȼ��������BaCO3������Ϊ����CO32-ʹBaSO4���ܽ�ƽ�����ܽⷽ���ƶ����Ӷ��γ�BaCO3���ʴ�Ϊ������CO32-ʹBaSO4���ܽ�ƽ�����ܽⷽ���ƶ����Ӷ��γ�BaCO3��
��MgΪ���ý�������ҵ��ͨ�������Mg�Ļ�ѧ����ʽΪMgCl2�����ڣ�
| ||
| ||
| bL |
| 22.4L/mol |
| 24b |
| 22.4 |
| 24c |
| 40 |
| ||||
| a |
�ʴ�Ϊ��MgCl2�����ڣ�
| ||
| ||||
| a |
�����������Ժ�ˮ��Դ�����ÿ�����������ᴿ��Ϊ��Ƶ���㣬���������еķ�Ӧ���������뷽��Ϊ���Ĺؼ�����2���е�⼰����Ϊ�����ѵ㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
�����ƶϻ������ȷ���ǣ�������
| A��25��ʱ��pH=4.7Ũ�Ⱦ�Ϊ0.1mol?L-1��CH2COOH��CH3COONa�����Һ�У�c��CH3COO-��+c��OH-����c��CH3COOH��+c��H+�� |
| B�������£���ˮ�루NH4��2SO4��Һ�������pH=7����Һ�У�c��NH4+����c��SO42-��=2��1 |
| C���������ͬ��pH��Ϊ1������ʹ���ֱ��ˮϡ����pH=3�����������仯��֤������������ |
| D����2.0mlŨ�Ⱦ�Ϊ0.1mol?L-1��KCl��KI���Һ�еμ�1-2��0.01mol?L-1AgNO3��Һ���������ʻ�ɫ��˵��AgCl��Ksp��AgI��KspС |
��ѧ�����������Ҷ�����CO2�����ɽ������Ͼ�̼����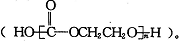 �����й�˵������ȷ���ǣ�������
�����й�˵������ȷ���ǣ�������
 �����й�˵������ȷ���ǣ�������
�����й�˵������ȷ���ǣ�������| A���Ҷ���������������Һ |
| B������CO2���ŷſɷ�ֹ���� |
| C����������һ���л��߷��Ӳ��� |
| D��������������ˮ�������ڽ��ⷢ�� |
��ɫ��Һ�к��У���Na+����Ba2+����Cl-����Br-����SO32-����SO42-����Fe2+�����е�һ�ֻ��֣����ν�������ʵ�飬��ÿ�������Լ����������۲쵽���������£�
��������ʵ�������ж����½�������ȷ���ǣ�������
| ���� | ���� | ���� |
| �� | ��pH��ֽ���� | ��Һ��pH����7 |
| �� | ����Һ�еμ���ˮ���ټ���CCl4�������� | CCl4��ʳ�ɫ |
| �� | ȡ�ڵ��ϲ���Һ������Ba��NO3��2��Һ��ϡHNO3 | �а�ɫ�������� |
| �� | ���۹��ˣ�����Һ�м���AgNO3��Һ��ϡHNO3 | �а�ɫ�������� |
| A���϶����е������Ǣ٢ܢ� |
| B���϶�û�е������Ǣڢݢ� |
| C�����ܺ��е������Ǣ٢ڢ� |
| D������ȷ���������Ǣ٢ۢ� |
�����й�ʵ���˵������ȷ���ǣ�������


| A���ù㷺pH��ֽ���0.051 mol?L-1 H2SO4��Һ��pH=1 |
| B��ij�����Ʊ�װ������ͼ����װ�ÿɼ�����Ⱦ�������й©�����������ռ������������ϵ͵����� |
| C���ڷ�Һ�����У�����Һ�ֲ�����������²�Һ��ų���Ȼ��ر����������ϲ�Һ����Ͽڵ��� |
| D��10mL��ˮ��5mL�������ϣ��ڹ��������ã�����Һ��Ϊ�ϡ��������Ҽ�����ɫʱ���ò�����պȡŨ��ˮ����Һ���Ϸ����ɹ۲쵽�а������� |
����������ȷ���ǣ�������
| A��Na2SO3��Һ��ͨ��CO2��Һ����ǣ�����ͨ��CO2��������������ʧ |
| B�������ܲ�ȡ����Һֱ�����ɵķ����Ƶ�AlCl3��Al2�� SO4��3��Fe Cl3��Fe2�� SO4��3 |
| C��Na��Mg��Cl�Ǻ�ˮ�е���ҪԪ�أ��Ӻ�ˮ���Ʊ�������Ԫ�ص��ʵķ�Ӧ��������������ԭ��Ӧ |
D��Ԫ��X�ĵ��ʼ�Ԫ��X��Y�γɵĻ������ܰ�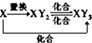 ��ϵ����ת������X��ΪFe��S ��ϵ����ת������X��ΪFe��S |
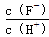 D��
D��