题目内容
2.同周期ⅡA族元素和ⅢA族元素,它们的原子序数原子序数之差不可能为( )| A. | 1 | B. | 10 | C. | 11 | D. | 25 |
分析 同周期ⅡA族元素和ⅢA族元素,若在短周期,位于相邻位置;在长周期中,中间相隔10个纵行,注意在六、七周期第3列中分别存在镧系和锕系,各有15种元素,以此来解答.
解答 解:同周期ⅡA族元素和ⅢA族元素,若设ⅡA族的原子序数为x,
若在短周期,二者原子序数相差1,则ⅢA族元素的原子序数为x+1;
若元素在四、五周期,中间相隔10个纵行,二者原子序数相差11,ⅢA族元素的原子序数为x+11;
若元素在六、七周期,中间有10个纵行,且存在镧系和锕系(各有15种元素),ⅡA族元素和ⅢA族元素的原子序数相差5,即ⅢA族元素的原子序数为x+25,
故选B.
点评 本题考查元素周期表结构及应用,为高频考点,把握元素的位置、原子序数的关系为解答的关键,侧重分析与应用能力的考查,注意镧系元素、锕系元素位置,题目难度不大.

练习册系列答案
相关题目
12.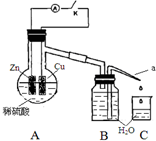 该同学用如下装置进行实验,分析影响反应速率的因素.
该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示.下列说法不正确的是( )
 该同学用如下装置进行实验,分析影响反应速率的因素.
该同学用如下装置进行实验,分析影响反应速率的因素.| 实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
| 实验Ⅱ(闭合K)1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
| A. | 实验Ⅰ中化学能主要转化为热能 | |
| B. | 实验Ⅱ中化学能主要转化为电能 | |
| C. | 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率 | |
| D. | 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ |
13.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
17.能正确表示下列反应的离子方程式的是( )
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
7.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,30s后,水蒸气的物质的量增加了4.5mol,则此反应的平均速率v (X)可表示为( )
| A. | v(NH3)=0.010mol•L-1•s-1 | B. | v (O2)=0.010mol•L-1•s-1 | ||
| C. | v (NO)=0.15mol•L-1•s-1 | D. | v (H2O)=0.15mol•L-1•s-1 |
14.有机物M的结构简式为: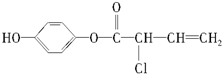 ,有关M的下列叙述中正确的是( )
,有关M的下列叙述中正确的是( )
 ,有关M的下列叙述中正确的是( )
,有关M的下列叙述中正确的是( )| A. | 可与H2反应,1 mol M最多消耗5 mol H2 | |
| B. | 可与浓溴水反应,1 mol M最多消耗4 mol Br2 | |
| C. | 可与NaOH溶液反应,1 mol M最多消耗4 mol NaOH | |
| D. | M不能使酸性高锰酸钾溶液褪色 |

 .
. .
.