题目内容
10.如图列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素⑧的名称是氖,元素⑧在周期表中所处位置第二周期0族.元素④的氢化物沸点高于⑦的氢化物沸点,原因是H2O分子间能形成氢键.
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是PH3<H2S<H2O(写氢化物的化学式).
(3)元素②④形成原子个数比为1:2的化合物的电子式是
 .
.(4)元素②形成的一类氢化物称为烷烃,通式是CnH2n+2,其中C4H10(填分子式)有两种同分异构体,结构简式分别是CH3CH2CH2CH3、CH3CH(CH3)CH3.
(5)用电子式表示⑤与⑦形成化合物的过程
 .
.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)⑧的名称是为氖,含氢键的分子沸点高;
(2)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(3)元素②④形成原子个数比为1:2的化合物为CO2;
(4)烷烃符合CnH2n+2,丁烷有两种同分异构体;
(5)⑤与⑦形成化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)⑧的名称是氖,位于第二周期0族,元素④为氧,元素④的氢化物沸点高于⑦的氢化物沸点,原因是H2O分子间能形成氢键,
故答案为:氖;第二周期0族;H2O分子间能形成氢键;
(2)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性O>S>P,非金属性越强,氢化物越稳定,故氢化物稳定性:PH3<H2S<H2O,
故答案为:PH3<H2S<H2O;
(3)元素②④形成原子个数比为1:2的化合物为CO2,其电子式为 ,故答案为:
,故答案为: ;
;
(4)元素②形成的一类氢化物称为烷烃,通式是CnH2n+2,其中C4H10有两种同分异构体,结构简式分别是CH3CH2CH2CH3、CH3CH(CH3)CH3,
故答案为:CnH2n+2;C4H10;CH3CH2CH2CH3、CH3CH(CH3)CH3;
(5)⑤与⑦形成化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为 ,
,
故答案为: .
.
点评 本题考查位置、结构、性质的综合应用,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及周期律的应用,题目难度不大.

| A. | 7.8gNa2S晶体中含有的S2-数目小于0.1NA | |
| B. | 1.68g铁与足量水蒸气反应,转移的电子数目为0.09NA | |
| C. | 11g由31H和168O组成的超重水中,含有的中子数目为5NA | |
| D. | 与17gH2O2所含非极性键数目相同的N2H4的分子数目为0.5NA |
| A. | N2和H2一定条件下反应制取NH3 | B. | 硝酸工厂用NH3氧化制取NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳酸氢铵和硫酸氨 |
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
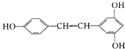
| A. | 是苯酚的同系物 | B. | 可发生加成、氧化、取代等反应 | ||
| C. | 所有原子可能共平面 | D. | 分子式为C14H12O3 |
| A. | 1 | B. | 10 | C. | 11 | D. | 25 |
| A. | 绿色食品是指不含任何化学物质的食品 | |
| B. | 硅是制造太阳能电池的常用材料 | |
| C. | NaOH溶液可以盛装在带橡皮塞的试剂瓶中 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
 D、H2 和D2
D、H2 和D2