题目内容
13.下列说法或表示方法中正确的是( )| A. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
分析 A、硫蒸气所含能量比硫固体多;
B、据燃烧热大过年分析;
C、氯化铵和氢氧化钡反应吸热;
D、浓硫酸溶于水放热.
解答 解:A、硫蒸气比硫固体所含能量高,等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多,故A错误;
B、燃烧热是指1mol可燃物燃烧放出的热量,热化学方程式中氢气是2mol,故B错误;
C、氯化铵和氢氧化钡反应吸热,△H>0,故C错误;
D、浓硫酸溶于水放热,故将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ,故D正确;
故选D.
点评 本题考查了焓变的求算、燃烧热、中和热、常见吸热反应,题目难度不大.

练习册系列答案
相关题目
15.乙炔气经CaCl2等净化处理后,在氮气氛中可催化聚合为聚乙炔,有关表示错误的是( )
| A. | 质子数与中子数均为20的钙原子:2040Ca | |
| B. | 氮分子的电子式::N:::N: | |
| C. | 氯离子(Cl-)的结构示意图: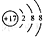 | |
| D. | 聚乙炔的结构简式: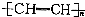 |
8.25℃时,pH=13的强碱溶液与0.01mol•L-1 c(H+)的强酸溶液混合,所得混合液的pH=12,则强碱与强酸的体积比是( )
| A. | 11:1 | B. | 9:1 | C. | 1:11 | D. | 2:9 |
18.下列反应属于氮的固定作用的是( )
| A. | N2和H2一定条件下反应制取NH3 | B. | 硝酸工厂用NH3氧化制取NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳酸氢铵和硫酸氨 |
5.下列说法中,可以说明恒容密闭容器中的反应:P(g)+Q(g)?R(g)+S(g)在恒温下已达平衡状态的是( )
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
2.同周期ⅡA族元素和ⅢA族元素,它们的原子序数原子序数之差不可能为( )
| A. | 1 | B. | 10 | C. | 11 | D. | 25 |
3.下列说法正确的是( )
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的物质变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
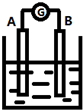 如图为原电池装置示意图:
如图为原电池装置示意图: D、H2 和D2
D、H2 和D2