题目内容
17.能正确表示下列反应的离子方程式的是( )| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
分析 A.不符合反应客观事实;
B.二氧化碳与苯酚钠反应生成苯酚和碳酸氢钠;
C.碳酸氢根离子为弱酸的酸式根离子,不能拆;
D.二者反应生成氢氧化铁沉淀和氯化镁.
解答 解:A.向氯化铝溶液中加入过量氨水,二者反应生成氢氧化铝,氢氧化铝不溶于氨水,离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.CO2通入苯酚钠溶液,离子方程式:C6H5O-+H2O+CO2→C6H5OH+HCO3-,故B错误;
C.NaHCO3溶液与稀H2SO4反应,离子方程式:HCO3-+H+═H2O+CO2↑,故C错误;
D.向FeCl3溶液中加入Mg(OH)2离子方程式:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+,故D正确;
故选:D.
点评 本题考查了离子方程式的正误判断,掌握离子方程式的书写原则,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
相关题目
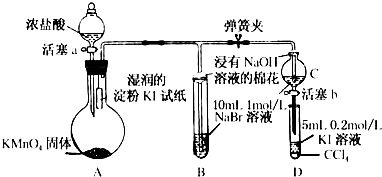
7.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素.实验条件作如下限定:
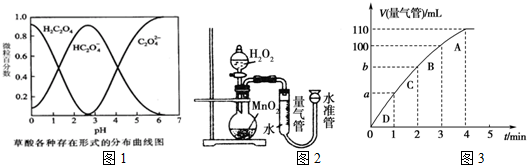
所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0,.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
①实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为1.0×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,
你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用.
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图3所示.
①实验时放出气体的总体积是110 mL.
②b小于(填“大于”“小于”或“等于”)90mL.

所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0,.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
①实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为1.0×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,
你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用.
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图3所示.
①实验时放出气体的总体积是110 mL.
②b小于(填“大于”“小于”或“等于”)90mL.
8.25℃时,pH=13的强碱溶液与0.01mol•L-1 c(H+)的强酸溶液混合,所得混合液的pH=12,则强碱与强酸的体积比是( )
| A. | 11:1 | B. | 9:1 | C. | 1:11 | D. | 2:9 |
5.下列说法中,可以说明恒容密闭容器中的反应:P(g)+Q(g)?R(g)+S(g)在恒温下已达平衡状态的是( )
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
12.下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
【实验一】实验步骤如下:
(1)设计该实验方案的目的是:探究同周期元素的性质(或金属性与非金属性)的递变规律.
(2)实验①的现象是生成浅黄色沉淀,反应的化学方程式是Cl2+Na2S=S↓+2NaCl.
【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
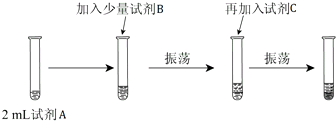
(3)试剂A是NaBr溶液;试剂B是氯水;试剂C是四氯化碳.
(4)试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,
加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色.
以上反应可以证明Cl2的非金属性强于(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2.
【实验一】实验步骤如下:
| 实验序号 | 实验步骤 |
| ① | 向新制的Na2S溶液中滴加新制的氯水 |
| ② | 将镁条投入1mol/L的稀盐酸中 |
| ③ | 将铝条投入1mol/L的稀盐酸中 |
(2)实验①的现象是生成浅黄色沉淀,反应的化学方程式是Cl2+Na2S=S↓+2NaCl.
【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.

(3)试剂A是NaBr溶液;试剂B是氯水;试剂C是四氯化碳.
(4)试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,
加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色.
以上反应可以证明Cl2的非金属性强于(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2.
2.同周期ⅡA族元素和ⅢA族元素,它们的原子序数原子序数之差不可能为( )
| A. | 1 | B. | 10 | C. | 11 | D. | 25 |
6.下列各组物质中,关系不正确的是( )
| A. | C3H8与C2H6互为同系物 | |
| B. | 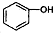 与 与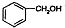 互为同系物 互为同系物 | |
| C. | 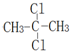 和 和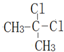 是同一种物质 是同一种物质 | |
| D. | 化学式为C5H10的有机物不一定能使溴的四氯化碳溶液褪色 |
7.在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”.凡具有一个手性碳原子的化合物一定具有光学活性.例如,有机物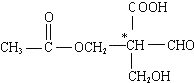 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )| A. | 与NaOH溶液共热 | B. | 与银氨溶液共热 | ||
| C. | 与金属钠反应 | D. | 与氢气发生加成反应 |
 ?
?