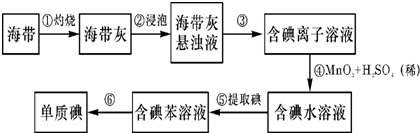
题目内容
4.龙胆酸甲醋(结构如图所示)是制备抗心律失常药物氟卡尼的中间体.下列有关龙胆酸甲醋的说法.正确的是( )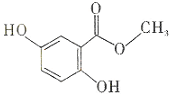
| A. | 分子式为C8H6O4 | B. | 所有的碳原子可能在同一平面内 | ||
| C. | 能发生消去反应 | D. | 能通过加聚反应生成高分子化合物 |
分析 该有机物中含有酯基和酚羟基、苯环,具有酯、酚和苯的性质,能发生水解反应、取代反应、氧化反应、加成反应等,据此分析解答.
解答 解:A.根据结构简式知,其分子式为C8H8O4,故A错误;
B.该分子具有苯结构,酯基中所有原子共平面,单键能旋转,所以所有的碳原子可能在同一平面内,故B正确;
C.该物质没有能发生消去反应的官能团,故C错误;
D.该物质中含有酚羟基,能发生缩聚反应,不含碳碳不饱和键,不能发生加聚反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,难点是判断C原子是否共平面,采用知识迁移的方法分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列有关同分异构体数目的叙述中,错误的是( )
| A. | C8H10中只有4种属于芳香烃的同分异构体 | |
| B. | CH3CH2CH2CH3光照下与氯气反应,生成2种一氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有3种 |
9.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)Q在元素周期表中的位置是第三周期第ⅢA族.基态Q原子的价电子排布图为 .
.
(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
16.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的位置的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
9.已知在1×105 Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
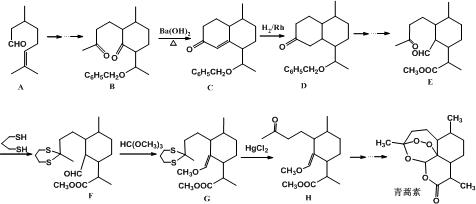
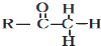 +
+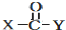 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$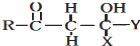
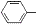 CH2CH2CHO)的路线流程图.路线流程图示例如下:
CH2CH2CHO)的路线流程图.路线流程图示例如下: .
.
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$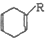
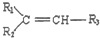 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$ +R3-COOH
+R3-COOH ,D的核磁共振氢谱共有3组峰.
,D的核磁共振氢谱共有3组峰.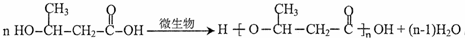 .
. (一种类似有机玻璃的塑料).第一步反应的化学方程式是
(一种类似有机玻璃的塑料).第一步反应的化学方程式是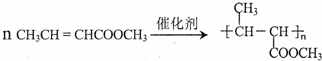 .
.