题目内容
19.锡及其化合物在生产、生活中有着重要的用途.已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃.请按要求回答下列相关问题:(1)元素锡比同主族碳的周期数大3,锡的原子序数为50.
(2)用于微电子器件生产的锡粉纯度测定:①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL.步骤②中加入Fe2(SO4)3的作用是将Sn2+全部氧化为Sn4+;此锡粉样品中锡的质量分数60%.
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图1:
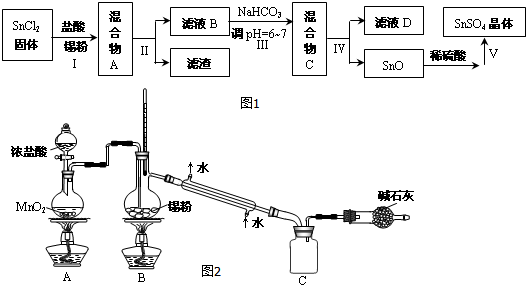
①步骤Ⅰ加入Sn粉的作用:防止Sn2+被氧化及调节溶液pH.
②步骤Ⅱ用到的玻璃仪器有烧杯、漏斗、玻璃棒.
③步骤Ⅲ生成SnO的离子方程式:Sn2++2HCO3-=SnO↓+2CO2↑+H2O.
④步骤Ⅳ中检验SnO是否洗涤干净的操作是取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,证明已洗净.
⑤步骤Ⅴ操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥.
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl.
实验室欲用图2装置制备少量SnCl4 (夹持装置略),该装置存在明显缺陷,改进方法是在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶.
利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
分析 (1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,根据电子转移守恒,整个过程关系式为:3Sn~3Sn2+~6Fe3+~6Fe2+~Cr2O72-,据此计算;
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等,
①由信息可知,Sn2+易被氧化,加入可防止Sn2+被氧化;
②步骤Ⅱ是过滤,根据过滤操作选用仪器;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
解答 解:(1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和,则Sn的原子序数为6+8+18+18=50,
故答案为:50;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
1.19g×x 0.100mol/L×0.02L
则:3×119g:1.19g×x=1mol:0.100mol/L×0.02L
解得:x=60%,
故答案为:将Sn2+全部氧化为Sn4+;60%;
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等,
①由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
②步骤Ⅱ是过滤,用到的玻璃仪器除烧杯外,还有漏斗、玻璃棒,
故答案为:漏斗;玻璃棒;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,说明洗涤干净
故答案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,
故答案为:蒸发浓缩、冷却结晶;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,
故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
点评 本题考查制备方案的设计,题目难度较大,涉及物质制备方案、化学工艺流程、物质含量测定、元素周期表与元素周期律等知识,是对学生综合能力的考查,需要学生具备扎实的基础与良好的心理素质,明确实验目的、实验原理为解答关键.

 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A. | a点水的离子积Kw=1.0×10-14 | |
| B. | b点:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
| A. | 升高温度,v(正)变大,v(逆)变小 | |
| B. | 恒温恒容,平衡前后混合气体的密度保持不变 | |
| C. | 恒温恒压,充入N2,平衡不移动 | |
| D. | 恒温恒容,充入O2,O2的转化率升高 |
| A. | C8H10中只有4种属于芳香烃的同分异构体 | |
| B. | CH3CH2CH2CH3光照下与氯气反应,生成2种一氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有3种 |
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag | |
| B. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高 | |
| C. | 已知每摩尔电子的电量为965 00 C,若称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中通过电解池的电量为96.5 C | |
| D. | 若要测定电解精炼铜时通过的电量,可将该银电量计中的银棒与待测电解池的粗铜电极相连 |
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).