题目内容
20.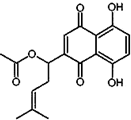 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
分析 该有机物中含有酯基、碳碳双键、羰基、苯环和酚羟基,具有酯、烯烃、酮、苯和酚的性质,能发生水解反应、取代反应、氧化反应、加成反应、加聚反应等,据此分析解答.
解答 解:A.该分子酯基中-O原子连接的碳原子为手性碳原子,故A正确;
B.含有酚羟基,具有酚的性质,能与氯化铁溶液发生显色反应,故B正确;
C.碳碳双键和苯环上酚羟基邻对位氢原子能与溴反应,所以1mol 乙酰紫草素最多可与4molBr2反应,故C错误;
D.酚羟基和酯基水解生成的羧基能和NaOH反应,1mol乙酰紫草素最多可与3molNaOH反应,故D错误;
故选CD.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酯、酚和烯烃性质,注意酚和溴反应取代位置,题目难度不大.

练习册系列答案
相关题目
10.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
11.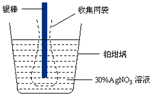 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag | |
| B. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高 | |
| C. | 已知每摩尔电子的电量为965 00 C,若称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中通过电解池的电量为96.5 C | |
| D. | 若要测定电解精炼铜时通过的电量,可将该银电量计中的银棒与待测电解池的粗铜电极相连 |
5.下列有关实验的说法不正确的是( )
| A. | 用广泛pH试纸测得0.05mol•L-1 H2SO4溶液的pH=1 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物一定为钾盐 | |
| C. | 滴定过程中,眼睛要始终注视锥形瓶中液体的颜色变化 | |
| D. | 配制FeSO4溶液时,先将FeSO4固体溶解在稀硫酸中,然后稀释到所需浓度,最后再加入少量铁粉 |
9.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)Q在元素周期表中的位置是第三周期第ⅢA族.基态Q原子的价电子排布图为 .
.
(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
5.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| B. | 标准状况下,11.2 LSO3含有的分子数目为0.5 NA | |
| C. | 7.8gNa2O2所含的离子数为0.4NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
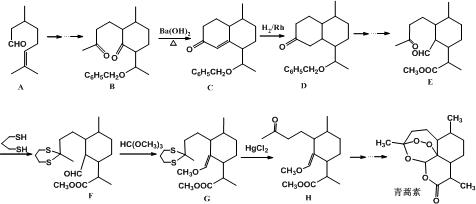
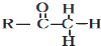 +
+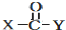 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$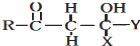
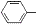 CH2CH2CHO)的路线流程图.路线流程图示例如下:
CH2CH2CHO)的路线流程图.路线流程图示例如下: .
.