题目内容
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置 ;B的原子结构示意图 ;
(2)E元素形成最高价氧化物对应水化物的化学式为 ;
(3)元素C、D、E形成的原子半径大小关系是 (用元素符号表示).
(4)C、D可形成化合物D2C2,D2C2含有的化学键是 ;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式 ,
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式 .
(1)D在周期表中的位置
(2)E元素形成最高价氧化物对应水化物的化学式为
(3)元素C、D、E形成的原子半径大小关系是
(4)C、D可形成化合物D2C2,D2C2含有的化学键是
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素,据此解答.
解答:
解:A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素,
(1)D为Na元素,在周期表中的位置是:第三周期第ⅠA族;B为N元素,原子结构示意图为 ,
,
故答案为:第三周期第ⅠA族; ;
;
(2)E为S元素,最高价为+6,最高价氧化物对应水化物为H2SO4,
故答案为:H2SO4;
(3)同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,
故答案为:Na>S>O;
(4)Na2O2含有的化学键是离子键、共价键,
故答案为:离子键、共价键;
(5)H、O两种元素形成的原子个数之比为1:1的化合物为H2O2,分子中O原子与H原子之间形成1对共用电子对、O原子之间形成1对共用电子对,其电子式为: ,
,
故答案为: ;
;
(6)氨气与硝酸反应生成硝酸铵,反应离子方程式为:NH3+H+=NH4+,
故答案为:NH3+H+=NH4+.
(1)D为Na元素,在周期表中的位置是:第三周期第ⅠA族;B为N元素,原子结构示意图为
 ,
,故答案为:第三周期第ⅠA族;
 ;
;(2)E为S元素,最高价为+6,最高价氧化物对应水化物为H2SO4,
故答案为:H2SO4;
(3)同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,
故答案为:Na>S>O;
(4)Na2O2含有的化学键是离子键、共价键,
故答案为:离子键、共价键;
(5)H、O两种元素形成的原子个数之比为1:1的化合物为H2O2,分子中O原子与H原子之间形成1对共用电子对、O原子之间形成1对共用电子对,其电子式为:
 ,
,故答案为:
 ;
;(6)氨气与硝酸反应生成硝酸铵,反应离子方程式为:NH3+H+=NH4+,
故答案为:NH3+H+=NH4+.
点评:本题考查位置结构性质关系应用,题目难度中等,注意正确推断元素的种类为解答该题的关键,需要学生全面掌握基础知识.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
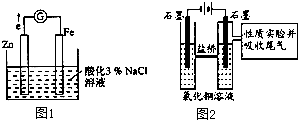
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
| 放电 |
| 充电 |
下列叙述不正确的是( )
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C、充电时阳极反应为:Fe(OH)3-3e-+5 OH-=FeO42-+4H2O |
| D、放电时正极附近溶液的碱性减弱 |
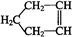 可简写为:
可简写为: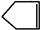
 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题: