题目内容
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是 (填名称),W在周期表中的位置 .
(2)X与Y 形成最简单化合物的电子式为 ,X与W组成的化合物中存在 键(填“离子”“共价”).
(3)①写出实验室制备YX3的化学方程式:
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2mol YX3气体时放出92.4kJ的热量,写出该反应的热化学方程式
(4)由X、Y、Z、W四种元素组成的一种离子化合物A.已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是 .
(1)X元素是
(2)X与Y 形成最简单化合物的电子式为
(3)①写出实验室制备YX3的化学方程式:
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2mol YX3气体时放出92.4kJ的热量,写出该反应的热化学方程式
(4)由X、Y、Z、W四种元素组成的一种离子化合物A.已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.则A的名称是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,然后利用元素及其单质、化合物的性质来解答.
解答:
解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素.
(1)由上述分析可知,X为H元素;W为S元素,位于元素周期表中第三周期第ⅥA族.
故答案为:H;第三周期第ⅥA族;
(2)H与N 形成的最简单化合物为NH3,其电子式为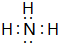 ,H与S组成的化合物为H2S,存在共价键,
,H与S组成的化合物为H2S,存在共价键,
故答案为: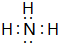 ;共价键;
;共价键;
(3)①实验室制备NH3的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②在该条件下每生成2mol NH3气体时放出92.4kJ的热量,该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol;
(4)离子化合物A由H、N、O、S四种元素组成,1mol A能与足量NaOH浓溶液反应,可生成44.8L气体(标准状况),则A为铵盐,生成氨气的物质的量=
=2mol,可推知A为(NH4)2SO3或(NH4)2SO4,
故答案为:亚硫酸铵或硫酸铵.
(1)由上述分析可知,X为H元素;W为S元素,位于元素周期表中第三周期第ⅥA族.
故答案为:H;第三周期第ⅥA族;
(2)H与N 形成的最简单化合物为NH3,其电子式为
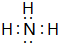 ,H与S组成的化合物为H2S,存在共价键,
,H与S组成的化合物为H2S,存在共价键,故答案为:
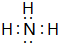 ;共价键;
;共价键;(3)①实验室制备NH3的化学方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②在该条件下每生成2mol NH3气体时放出92.4kJ的热量,该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol;
(4)离子化合物A由H、N、O、S四种元素组成,1mol A能与足量NaOH浓溶液反应,可生成44.8L气体(标准状况),则A为铵盐,生成氨气的物质的量=
| 44.8L |
| 22.4L/mol |
故答案为:亚硫酸铵或硫酸铵.
点评:本题考查位置结构性质的关系,侧重对常用化学用语的考查,由Y、Z、W的位置及原子序数的关系来推断元素是解答本题的关键,难度中等.

练习册系列答案
相关题目
由CO、CO2组成的混合气体36g,其中含C原子数为NA个,则C、O原子个数比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |

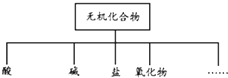 无机化合物可根据其组成和性质进行分类.
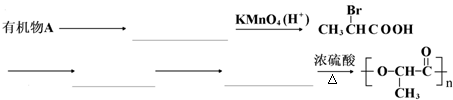
无机化合物可根据其组成和性质进行分类.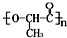 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)