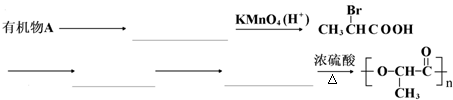
题目内容
 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:其中,氧化反应为:
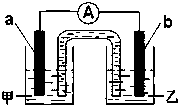
(2)由题(1)反应,设计成原电池如图所示:若电极a为Zn,电极b可选择材料:
电解质溶液甲是
(3)由反应2H2+O2
| ||
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)失电子的物质发生氧化反应;
(2)将反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,电极和相应的电解质溶液含有相同的阳离子,正极上得电子发生还原反应;
(3)由反应2H2+O2
2H2O,设计出以稀硫酸为电解质溶液的燃料电池,负极上燃料失电子发生氧化反应,正极上氧气得电子发生还原反应.
(2)将反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,电极和相应的电解质溶液含有相同的阳离子,正极上得电子发生还原反应;
(3)由反应2H2+O2
| ||
解答:
解:(1)根据方程式知,锌失电子发生氧化反应,所以其反应式为:Zn=Zn2++2e-,
故答案为:Zn=Zn2++2e-;
(2)反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,如铜等,电极和相应的电解质溶液含有相同的阳离子,可以是硫酸锌溶液,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:Cu;ZnSO4;2H++2e-=H2↑;
(3)由反应2H2+O2
2H2O,设计出以稀硫酸为电解质溶液的燃料电池,负极上失电子发生氧化反应,电极反应式为:2H2-4e-=4H+,正极上氧气得电子发生还原反应,电极反应式为:O2+4H++4e-=2H2O,
故答案为:负极:2H2-4e-=4H+,正极:O2+4H++4e-=2H2O.
故答案为:Zn=Zn2++2e-;
(2)反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,如铜等,电极和相应的电解质溶液含有相同的阳离子,可以是硫酸锌溶液,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:Cu;ZnSO4;2H++2e-=H2↑;
(3)由反应2H2+O2
| ||
故答案为:负极:2H2-4e-=4H+,正极:O2+4H++4e-=2H2O.
点评:本题考查原电池原理和电解池原理,电极反应式的书写是学习难点,书写时要结合电解质溶液的酸碱性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
由CO、CO2组成的混合气体36g,其中含C原子数为NA个,则C、O原子个数比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
原电池在工作时,发生氧化还原反应,下列反应不可能作为原电池工作时发生的反应的是( )
| A、Cu+2AgNO3═Cu(NO3)2+2Ag |
| B、2Fe+O2+2H2O═2Fe(OH)2 |
| C、NaOH+HCl═NaCl+H2O |
| D、2H2+O2═2H2O |
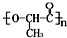 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)