题目内容
某化学兴趣小组对电化学问题进行了实验探究.
Ⅰ.利用如图1装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.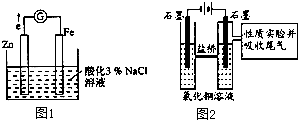
(1)写出负极的电极反应式 .
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3: .
(3)为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 .
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 .
Ⅱ.利用图2装置作电解50mL 0.5mol/L的CuCl2溶液实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:
① ;
② .
(2)分析实验记录B中浅蓝色固体可能是 (写化学式),试分析生成该物质的原因 .
Ⅰ.利用如图1装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.

(1)写出负极的电极反应式
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:
(3)为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施
Ⅱ.利用图2装置作电解50mL 0.5mol/L的CuCl2溶液实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:
①
②
(2)分析实验记录B中浅蓝色固体可能是
考点:探究原电池及其工作原理,电解原理
专题:实验设计题,电化学专题
分析:I.(1)该装置能自发进行氧化还原反应而形成原电池,锌易失电子而作负极、铁作正极;
(2)铁参与反应,被氧化生成亚铁离子和铁离子;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液;
(4)可以采用物理或化学方法防止金属被腐蚀;
II.(1)氯气能氧化碘离子生成碘单质,碘能被氯气氧化生成碘酸;
(2)阴极上铜离子浓度下降,氢离子放电同时溶液中还生成氢氧根离子,氢氧根离子和铜离子生成蓝色沉淀.
(2)铁参与反应,被氧化生成亚铁离子和铁离子;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液;
(4)可以采用物理或化学方法防止金属被腐蚀;
II.(1)氯气能氧化碘离子生成碘单质,碘能被氯气氧化生成碘酸;
(2)阴极上铜离子浓度下降,氢离子放电同时溶液中还生成氢氧根离子,氢氧根离子和铜离子生成蓝色沉淀.
解答:
解:I.(1)该装置能自发进行氧化还原反应而形成原电池,锌易失电子而作负极、铁作正极,负极上电极反应式为Zn-2e-=Zn2+,
故答案为:Zn-2e-=Zn2+;
(2)铁参与反应,被氧化生成Fe2+、Fe3+,故答案为:铁参与反应,被氧化生成Fe2+、Fe3+;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液,据②、③、④现象知,正极附近溶液不含Fe2+、Fe3+,即铁不参与反应,
故答案为:正极附近溶液不含Fe2+、Fe3+;
(4)可以采用物理或化学方法防止金属被腐蚀,如:在钢铁表面刷一层油漆、镀铜等,
故答案为:在钢铁表面刷一层油漆、镀铜;
II.(1)氯气能氧化碘离子生成碘单质,碘能被氯气氧化生成碘酸,离子方程式分别为:2I-+Cl2=I2+2Cl-、5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,
故答案为:2I-+Cl2=I2+2Cl-;5Cl2+I2+6H2O=10Cl-+2IO3-+12H+;
(2)阴极上电极反应式为:Cu 2++2e-=Cu,当铜离子放电完毕后,氢离子放电,2H++2e-=H2↑,致使该电极附近呈碱性,Cu 2++2OH-=Cu(OH)2↓,
故答案为:Cu(OH)2;电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的pH增大,铜离子转化为氢氧化铜沉淀.
故答案为:Zn-2e-=Zn2+;
(2)铁参与反应,被氧化生成Fe2+、Fe3+,故答案为:铁参与反应,被氧化生成Fe2+、Fe3+;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液,据②、③、④现象知,正极附近溶液不含Fe2+、Fe3+,即铁不参与反应,
故答案为:正极附近溶液不含Fe2+、Fe3+;
(4)可以采用物理或化学方法防止金属被腐蚀,如:在钢铁表面刷一层油漆、镀铜等,
故答案为:在钢铁表面刷一层油漆、镀铜;
II.(1)氯气能氧化碘离子生成碘单质,碘能被氯气氧化生成碘酸,离子方程式分别为:2I-+Cl2=I2+2Cl-、5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,
故答案为:2I-+Cl2=I2+2Cl-;5Cl2+I2+6H2O=10Cl-+2IO3-+12H+;
(2)阴极上电极反应式为:Cu 2++2e-=Cu,当铜离子放电完毕后,氢离子放电,2H++2e-=H2↑,致使该电极附近呈碱性,Cu 2++2OH-=Cu(OH)2↓,
故答案为:Cu(OH)2;电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的pH增大,铜离子转化为氢氧化铜沉淀.
点评:本题以原电池原理为载体考查了铁的探究实验,根据反应现象确定正负极上发生的反应,知道亚铁离子、铜离子的检验方法、氯气不仅能氧化碘离子还能氧化碘单质,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列元素肯定属于主族元素的是( )
| A、最高正价为+7价的一种元素 |
| B、除最外层电子外,其余各层都达到饱和的一种元素 |
| C、原子L层比M层多6个电子的一种元素 |
| D、最外层电子数为8的一种元素 |
由CO、CO2组成的混合气体36g,其中含C原子数为NA个,则C、O原子个数比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、16gO2中含有的氧分子数为NA |
| B、1mol镁原子中含有的电子数为NA |
| C、常温常压下,11.2L H2中含有的氢分子数为0.5NA |
| D、1L 1mol/L BaCl2溶液中含有的钡离子数为NA |
下列电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
