题目内容
16.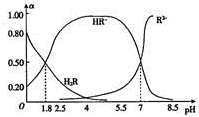 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
分析 A.根据pH=1.8时c(HR-)=c(H2R)及Kal=$\frac{c(H{R}^{-})•c({H}^{+})}{c({H}_{2}R)}$计算;
B.根据H2R溶液中的电荷守恒分析;
C.根据图象可知,溶液呈酸性,则c(H+)>c(OH-),再结合图象曲线判断c(HR-)、c(R2-)的大小;
D.pH=7时,溶液中主要存在HR-、R2-,加入稀硫酸后HR-的物质的量增大.
解答 解:A.根据图象可知,pH=1.8时c(HR-)=c(H2R),Kal=$\frac{c(H{R}^{-})•c({H}^{+})}{c({H}_{2}R)}$=c(H+)=10-1.8≠0.25,故A错误;
B.pH=2.5的H2R溶液中氢离子浓度为l0-2.5mol/L,根据电荷守恒可得:c(HR-)+2c(R2-)+c(OH-)=c(H+)=l0-2.5,故B正确;
C.根据图象可知溶液呈酸性,则c(H+)>c(OH-),由图象曲线可知c(HR-)>c(R2-),则此时溶液中离子浓度大小为:c(HR-)>c(R2-)>c(H+)>c(OH-),故C正确;
D.根据图象可知,pH=7时的溶液中主要存在HR-、R2-,加入稀硫酸后HR-的物质的量增大,则a(HR-)增大,故D错误;
故选AD.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响电离平衡的因素为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
6.在一密闭容器中,反应 aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,
达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是( )
达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增加了 | ||
| C. | 物质B的质量分数减少了 | D. | b>a |
7.液流电池是一种新型可充电的高性能蓄电池,其工作原理如图.两边电解液存储罐盛放的电解液分别是含有V3+、V的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环.下列说法不正确的是( )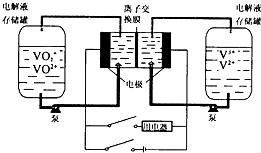

| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
4.加入适量盐酸能使下列离子浓度降低的是( )
| A. | CO32- | B. | SO42- | C. | Cl- | D. | Na+ |
8. 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
下列叙述错误的是( )
 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:下列叙述错误的是( )
| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
5.下列表述正确的是( )
| A. | SO3和NxOy都属于酸性氧化物 | |
| B. | 实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸 | |
| C. | 锶与镁、钙、钡同族,由于碳酸钙和碳酸钡都难溶,所以碳酸锶也难溶 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 |
6.所谓合金,就是不同种金属(也包括一些非金属)在熔融状态下形成的一种熔合物,根据下列四种金属的熔、沸点:
其中不能形成合金的是( )
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
| A. | Cu和Na | B. | Fe和Cu | C. | Cu与Al | D. | Al与Na |
