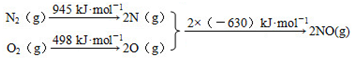题目内容
7.液流电池是一种新型可充电的高性能蓄电池,其工作原理如图.两边电解液存储罐盛放的电解液分别是含有V3+、V的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环.下列说法不正确的是( )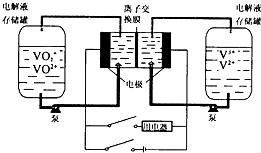
| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
分析 A、充电时,阴极上得电子发生还原反应;
B、放电时,正极上发生得电子的还原反应,负极上发生失电子的氧化反应;
C、充电时,电解质溶液中的氢离子向阴极移动,转移电子的物质的量和氢离子物质的量是相等的;
D、放电过程中,电解质溶液中的阴离子向负极移动.
解答 解:A、充电时,阴极上得电子发生还原反应,电极反应为V3+被还原生成v2+,即V3++e-=V2+,故A正确;
B、放电时,正极上发生得电子的还原反应,VO2++2H++e-=VO2++H2O,VO2+作氧化剂,在正极被还原,负极上发生失电子的氧化反应,V2+-e-=V3+,V2+做还原剂,在负极被氧化,故B正确;
C、充电时,电解质溶液中的氢离子向阴极移动,转移电子的物质的量和氢离子物质的量是相等的,充电时当有1mole-发生转移时,右槽为阴极,右槽电解液的H+的物质的量增加了1mol,故C错误;
D、放电过程中,电解质溶液中的阴离子向负极移动,即放电时阴离子由左罐移向右罐,故D正确.
故选C.
点评 本题考查原电池的工作原理,题目难度中等,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.

练习册系列答案
相关题目
8.在CO2的水溶液中,H2CO3达到电离平衡的标志是( )
| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
16.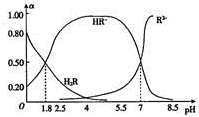 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
17.常温下,浓度均为0.1mol/L的6种溶液的pH如下表:
(1)上述溶液中的阴离子结合H +能力最弱的为CO32-(填阴离子化学式)
(2)NaAlO 2溶液呈碱性的原因是AlO2-+2H2O?Al(OH)3+OH-(用离子方程式表示).将溶液加热蒸干最后得到的固体产物是NaAlO2;
(3)结合表中数据分析,与0.1mol/L的CH 3COONa溶液中水的电离程度相同的有BE(填字母代号).
A.pH=8.8的NaOH溶液 B.pH=5.2的NH 4Cl溶液 C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液 E.pH=8.8的Na 2CO 3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有BDE.
A.c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
F.c(Na+)>c(CO32-)>c(HCO3-)>c(H+)>c(OH-)
(5)0.2mol/LHCl与0.1mol/L NaAlO 2溶液等体积混合溶液后离子浓度顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-).
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(2)NaAlO 2溶液呈碱性的原因是AlO2-+2H2O?Al(OH)3+OH-(用离子方程式表示).将溶液加热蒸干最后得到的固体产物是NaAlO2;
(3)结合表中数据分析,与0.1mol/L的CH 3COONa溶液中水的电离程度相同的有BE(填字母代号).
A.pH=8.8的NaOH溶液 B.pH=5.2的NH 4Cl溶液 C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液 E.pH=8.8的Na 2CO 3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有BDE.
A.c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
F.c(Na+)>c(CO32-)>c(HCO3-)>c(H+)>c(OH-)
(5)0.2mol/LHCl与0.1mol/L NaAlO 2溶液等体积混合溶液后离子浓度顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-).