题目内容
14.某学生的实验报告所列出的下列数据中合理的是( )| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用25ml酸式滴定管量取21.70 mLKMnO4溶液 | |
| D. | 用托盘天平称量25.20 g NaCl |
分析 A.量筒精确到0.1mL;
B.广泛pH试纸精确到1;
C.高锰酸钾具有强氧化性,可用酸式滴定管量取;
D.托盘天平精确到0.1g.
解答 解:A.量筒的准确度为0.1mL,无法用10mL量筒量取7.13mL稀盐酸,故A错误;
B.pH试纸测定的溶液的酸碱性都是整数,不会出现小数,故B错误;
C.高锰酸钾具有强氧化性,可用酸式滴定管量取,且酸式滴定管可量取0.01mL,故C正确;
D.托盘天平精确到0.1g,不能量取25.20g,故D错误.
故选C.
点评 本题考查各种仪器的使用方法及使用注意事项,特别是天平、量筒的使用、酸碱度的测定在中考中出现频度较高,其读数方法和误差的分析更是重中之重,题目难度不大.

练习册系列答案
相关题目
2.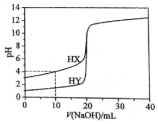 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
9.反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
19.已知有如下反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
3.某化合物通过化合反应生成,向其水溶液中加入足量Na2O2,最终有白色沉淀产生.下列化合物中符合上述条件的是( )
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
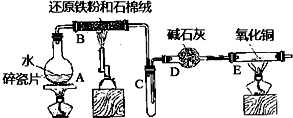
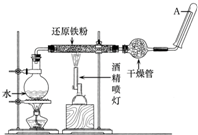 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.