题目内容
9.反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
分析 2min后测得N2的浓度为0.6mol/L,则v(N2)=$\frac{0.6mol/L}{2min}$=0.3mol/(L•min),然后结合速率之比等于化学计量数之比计算.
解答 解:2min后测得N2的浓度为0.6mol/L,则v(N2)=$\frac{0.6mol/L}{2min}$=0.3mol/(L•min),
由速率之比等于化学计量数之比可知,
v(CO)=0.3mol/(L•min)×4=1.2 mol/(L•min),
v(NO2)=0.3 mol/(L•min)×2=0.6 mol/(L•min),
v(CO2)=0.3mol/(L•min)×4=1.2 mol/(L•min),
故选D.
点评 本题考查化学反应速率与化学计量数的关系,为高频考点,把握速率的计算及速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,注意速率的单位,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
20.某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入3mL浓硫酸、12.2g苯甲酸、20mL甲醇(密度约为0.79g/cm3).
(1)液体混合时,正确的加入顺序是先加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸.
(2)为防止圆底烧瓶中的液体在实验时发生暴沸,在加热前应采取的措施是加入沸石或碎瓷片.
(3)在该反应中反应物甲醇应过量,其理由是该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,故可增加甲醇的量,以提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(4)现拟用下列流程精制苯甲酸甲酯,请根据流程图填入恰当操作方法的名称:操作1为分液,操作2为蒸馏.
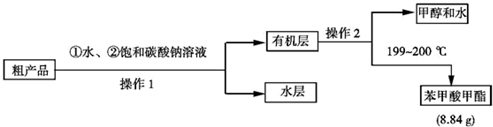
(5)苯甲酸甲酯的产率为65%.
(6)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,某同学做了如下检验.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
在圆底烧瓶中加入3mL浓硫酸、12.2g苯甲酸、20mL甲醇(密度约为0.79g/cm3).
(1)液体混合时,正确的加入顺序是先加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸.
(2)为防止圆底烧瓶中的液体在实验时发生暴沸,在加热前应采取的措施是加入沸石或碎瓷片.
(3)在该反应中反应物甲醇应过量,其理由是该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,故可增加甲醇的量,以提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(4)现拟用下列流程精制苯甲酸甲酯,请根据流程图填入恰当操作方法的名称:操作1为分液,操作2为蒸馏.

(5)苯甲酸甲酯的产率为65%.
(6)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,某同学做了如下检验.
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
17.下列关于能量转化的说法不正确的是( )
| A. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为放热反应 | |
| B. | 氢氧燃料电池使用时是将热能转化成电能 | |
| C. | 人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 | |
| D. | 太阳能光电池将太阳能直接转换为电能 |
4.下列实验操作正确的是( )
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 使用容量瓶时,先检验其是否漏水,然后洗净后,不用干燥即可使用 | |
| C. | 可用10mL量筒量取8.58mL蒸馏水 | |
| D. | 在配制溶液定容后,上下翻转摇匀后发现液面下降,须加水至溶液凹液面与刻度线相切 |
14.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用25ml酸式滴定管量取21.70 mLKMnO4溶液 | |
| D. | 用托盘天平称量25.20 g NaCl |
1.某无色透明的溶液中加入金属锌有H2放出,则在该溶液中一定能大量共存的是( )
| A. | Cu2+ Cl- K+ SO42- | B. | Na+ NO3 - OH - CO3 2- | ||
| C. | Ba2+ Cl- NO3 - SO4 2- | D. | K+ Na+ Cl- SO4 2- |
18.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示.下列说法一定正确的是( )
| X | Y |
| Z |
| A. | 气态氢化物的沸点:X<Y<Z | |
| B. | 最高正化合价:Y>X | |
| C. | X、Y、Z的最高价氧化物对应水化物中,Z的酸性最强 | |
| D. | 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素 |
19.下列与实验相关的叙述,正确的是( )
| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |