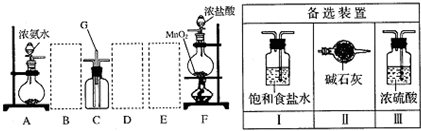
题目内容
17.依据下图判断,下列叙述正确的是( )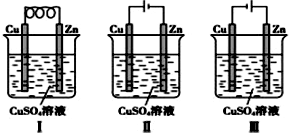
| A. | Ⅰ是原电池,Ⅱ是电镀装置 | |
| B. | Ⅰ、Ⅱ装置中锌极上均发生氧化反应 | |
| C. | Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 | |
| D. | Ⅱ、Ⅲ装置中Cu2+浓度基本不变 |
分析 A、Ⅰ装置没有外加电源,属于原电池,Ⅱ装置存在外加电源,属于电解池;
B、在原电池的负极上发生氧化反应,在电解池的阴极上,发生还原反应;
C、在电解池的阳极上发生的是失电子的氧化反应,根据电极材料确定发生的反应;
D、根据电解池的阴极上的反应来判断.
解答 解:A、Ⅰ装置没有外加电源,属于原电池,Ⅱ装置存在外加电源,属于电解池,可以在锌上镀铜,故A正确;
B、Ⅰ装置中,锌是负极,该电极上锌失电子发生氧化反应,Ⅱ装置中,锌极是阴极,该电极上发生还原反应,故B错误;
C、Ⅱ装置Cu作阳极,阳极上Cu失电子发生氧化反应,Ⅲ装置中,铜作阴极,锌作阳极,阳极上锌失电子发生氧化反应,故C错误;
D、Ⅱ装置是电镀装置,铜离子浓度不变,但是Ⅲ装置中阴极铜离子得电子生成铜单质,阳极上锌失电子生成锌离子,所以溶液中铜离子浓度减少,故D错误.
故选A.
点评 本题考查学生原电池和电解池的工作原理知识,注意把握电镀池的特点以及电解精炼铜装置的特点区别是关键,题目难度中等,侧重于考查学生的分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.乙醇是一种重要的化工原料,在人们日常生活中有广泛应用.下列关于乙醇的说法不正确的是( )
| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
2.控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断正确的是( )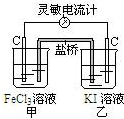

| A. | 反应开始时,乙中石墨电极上发生还原反应 | |
| B. | 反应开始时,甲中石墨电极上Fe3+被氧化 | |
| C. | 盐桥中的K+向乙中迁移,Cl-向甲中迁移 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为正极 |
7.某烷烃的结构为其一 氯取代物有几种( )
氯取代物有几种( )
 氯取代物有几种( )
氯取代物有几种( )| A. | 4 | B. | 5 | C. | 3 | D. | 6 |

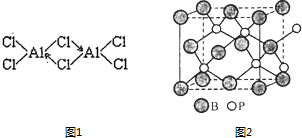 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: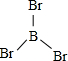 三溴化磷
三溴化磷
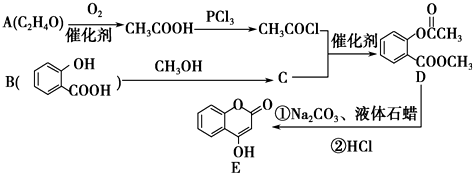
 +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O.
+H2O. 是一种重要的有机合成中间体.
是一种重要的有机合成中间体. ;②光照时,甲苯与Cl2侧链取代.
;②光照时,甲苯与Cl2侧链取代.