题目内容
7.乙醇是一种重要的化工原料,在人们日常生活中有广泛应用.下列关于乙醇的说法不正确的是( )| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
分析 依据乙醇为无色液体,能够与水以任意比例混溶,乙醇具有还原性能够被氧化生成乙醛,据此解答.
解答 解:A.乙醇为无色液体,故A正确;
B.乙醇具有还原性,能够被氧气氧化生成乙醛,故B正确;
C.乙醇易溶于水,与水以任意比例混溶,故C正确;
D.乙醇与氢氧化钠不反应,故D错误;
故选:D.
点评 本题考查了乙醇的性质,熟悉乙醇的物理性质和化学性质是解题关键,题目难度不大.

练习册系列答案
相关题目
15.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,使压强刚好与外界相等.在相同温度下,发生2SO2+O2?2SO3并达到平衡.在这个过程中,甲容器保持体积不变,乙容器保持压强不变.若甲容器中SO2 的转化率为α,则乙容器中SO2 的转化率为( )
| A. | 等于α | B. | 大于α | C. | 小于α | D. | 无法确定 |
19.已知H2(g)+I2(g)?2HI(g)△H<0,有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各1mol,乙中加入HI2mol,相同温度下分别达到平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A. | 甲、乙提高相同温度 | B. | 甲中加入1molHe,乙不变 | ||
| C. | 甲降低温度,乙不变 | D. | 甲增加1molH2,乙增加1molI2 |
16.密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示.下列说法正确的是( )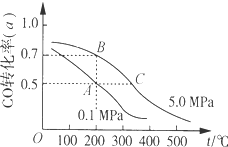

| A. | A、B两点表示在某时刻达到平衡状态,此时A、B两点时容器中,n(A)总:n(B)总=4:5 | |
| B. | 在A点时保持恒温恒容,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) | |
| C. | 若开始时向容器中充入1mol CO与2mol H2,达到平衡(与A点相同温度压强)时,CO的 转化率小于50% | |
| D. | 在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
17.依据下图判断,下列叙述正确的是( )
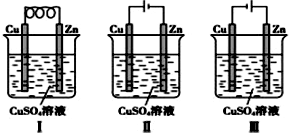

| A. | Ⅰ是原电池,Ⅱ是电镀装置 | |
| B. | Ⅰ、Ⅱ装置中锌极上均发生氧化反应 | |
| C. | Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 | |
| D. | Ⅱ、Ⅲ装置中Cu2+浓度基本不变 |
 3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式
3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式