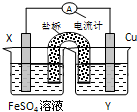
题目内容
7.某烷烃的结构为其一 氯取代物有几种( )
氯取代物有几种( )| A. | 4 | B. | 5 | C. | 3 | D. | 6 |
分析 烷烃的一氯取代物只有一种,说明该烷烃中只有一种等效氢原子,根据等效氢原子的判断方法来回答.
解答 解:烷烃分子中,同一个碳上的氢原子等效,连在同一个碳原子上的甲基氢原子等效,具有镜面对称的碳原子上的氢原子等效, 含有5种等效氢原子,所以一氯取代物有5种.
含有5种等效氢原子,所以一氯取代物有5种.
故选B.
点评 本题考查学生同分异构体的概念和应用知识,要求学生具有整合知识的能力,难度不是很大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.依据下图判断,下列叙述正确的是( )
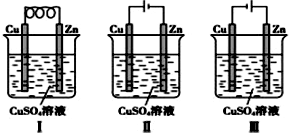

| A. | Ⅰ是原电池,Ⅱ是电镀装置 | |
| B. | Ⅰ、Ⅱ装置中锌极上均发生氧化反应 | |
| C. | Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解 | |
| D. | Ⅱ、Ⅲ装置中Cu2+浓度基本不变 |
18.镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点.其中一种镁电池的反应原理为:XMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4下列说法正确的是( )
| A. | 放电时,Mo3S4发生氧化反应 | |
| B. | 放电时,负极反应式:Mo3S4+2xe-→Mo3S42x- | |
| C. | 充电时,Mg2+向阴极迁移 | |
| D. | 充电时,阳极反应式:xMg2++2xe-→xMg |
15.下列说法正确的是( )
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
19.下列关于0.5mol•L-1Al2(SO4)3溶液的叙述中,不正确的是( )
| A. | Al3+与SO42-的物质的量浓度之比为2:3 | |
| B. | 1L溶液中SO42-的物质的量为1.5mol | |
| C. | 准确称取17.1g的Al2(SO4)3用100 mL蒸馏水溶解可配制得到该浓度的溶液 | |
| D. | 从1L 0.5 mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1 mol•L-1 |
16.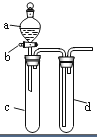 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是检查装置的气密性.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙.
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是稀盐酸,c中加入的试剂是大理石(或Na2CO3固体),d中加入的试剂是Na2SiO3溶液;实验现象为c中有气泡产生,d中生成白色胶状物质(或白色沉淀).但此实验存在不足之处,改进的措施是在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶.
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是检查装置的气密性.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是稀盐酸,c中加入的试剂是大理石(或Na2CO3固体),d中加入的试剂是Na2SiO3溶液;实验现象为c中有气泡产生,d中生成白色胶状物质(或白色沉淀).但此实验存在不足之处,改进的措施是在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶.
17.下列有关实验,所选的装置合理的是( )
| A. | 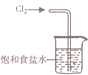 用装置吸收多余的氯气 | B. | 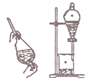 装置用酒精萃取分离水中的碘 | ||
| C. | 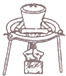 用装置除去纯碱中的小苏打 | D. |  用装置排水法收集氨气 |
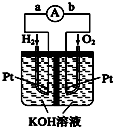 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.