题目内容
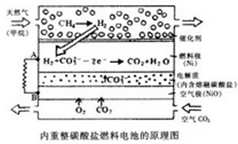 以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )| A、该电池将热能转化为电能 |
| B、外电子流动方向:由B流向A |
| C、空气极发生电极反应式为:O2+4c-+2CO2=2CO32- |
| D、以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.原电池是将化学能 转化为热能的装置;
B.燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,电子由负极流向正极;
C.空气极是氧气得到电子,生成碳酸根离子的反应;
D.电解精炼铜,负极放电的顺序为活泼性强于铜的锌、铁等,然后是铜;
B.燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,电子由负极流向正极;
C.空气极是氧气得到电子,生成碳酸根离子的反应;
D.电解精炼铜,负极放电的顺序为活泼性强于铜的锌、铁等,然后是铜;
解答:
解:A.该装置为原电池,原电池是将化学能 转化为热能的装置,故A错误;
B.燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,电子由负极流向正极,装置中A为负极,B为正极,所以外电路电子流向为A流向B,故B错误;
C.空气极是氧气得到电子,生成碳酸根离子的反应,电极反应式为:O2+4c-+2CO2=2CO42-,故C正确;
D.电解精炼铜时,负极锌、铁先于铜放电,当有0.1mole-转移时,溶解的铜的质量小于3.2g,故D错误;
故选:C.
B.燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,电子由负极流向正极,装置中A为负极,B为正极,所以外电路电子流向为A流向B,故B错误;
C.空气极是氧气得到电子,生成碳酸根离子的反应,电极反应式为:O2+4c-+2CO2=2CO42-,故C正确;
D.电解精炼铜时,负极锌、铁先于铜放电,当有0.1mole-转移时,溶解的铜的质量小于3.2g,故D错误;
故选:C.
点评:本题考查了燃料电池、电解法精炼铜过程,明确原电池、电解池工作原理是解题关键,题目难度中等.

练习册系列答案
相关题目
已知:CaCO3(s)?CaO(s)+CO2(g)△H>0,△S>0,则该反应能自发进行的条件是( )
| A、低温 |
| B、高温 |
| C、任何温度下都能自发进行 |
| D、任何温度下都不能自发进行 |
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | ||||
| B、铅蓄电池放电过程中,正极质量增加,负极质量减小 | ||||
C、25℃下,在NH3?H2O稀溶液中,加水,
| ||||
| D、在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
如图甲池和乙池中的四个电极都是铂电极,乙池为K1溶液.请根据图示判断下列有关说法正确的是( )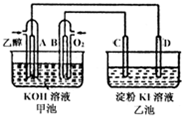

| A、甲池是电解池,乙池是原电池 |
| B、原电池的正极反应式为:C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C、反应一段时间后,两池溶液的pH均未变化 |
| D、反应一段时间后,C极附近溶液变蓝 |
下列关于物质的量浓度表述正确的是( )
| A、0.3mol?L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol |
| B、当1L水吸收22.4L(标准状况)氨气时所得氨水的浓度是1mol?L-1 |
| C、在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 |
| D、10℃的0.35mol?L-1的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时过滤,其滤液中溶质的物质的量浓度仍为0.35mol?L-1 |
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”.中国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3的作用是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
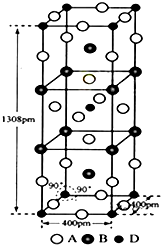 前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题:
前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题: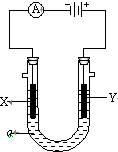 如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: