题目内容
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | ||||
| B、铅蓄电池放电过程中,正极质量增加,负极质量减小 | ||||
C、25℃下,在NH3?H2O稀溶液中,加水,
| ||||
| D、在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
考点:焓变和熵变,原电池和电解池的工作原理,弱电解质在水溶液中的电离平衡
专题:
分析:A、依据反应自发想的判断依据是△H-T△S<0,结合反应特征分析;
B、两极均生成硫酸铅沉淀;
C、根据影响K阿和Kw的因素分析;
D、HS-电离出的S2-与Cu2+结合生成CuS沉淀.
B、两极均生成硫酸铅沉淀;
C、根据影响K阿和Kw的因素分析;
D、HS-电离出的S2-与Cu2+结合生成CuS沉淀.
解答:
解:A、依据反应自发想的判断依据是△H-T△S<0,结合反应特征分析,反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,△H-T△S>0,反应的熵变△S>0,则△H>0,故A错误;
B、铅蓄电池放电过程中,正极上二氧化铅转化为硫酸铅,负极上铅单质转化为硫酸铅,两极质量均增加,故B错误;
C、在NH3?H2O稀溶液中,
=
=
,温度不变,则Kw和Ka不变,所以加水,
的值不变,故C正确;
D、在NaHS溶液中,滴入少量CuCl2溶液,HS-电离出的S2-与Cu2+结合生成CuS沉淀,HS-电离程度增大,pH减小,故D错误;
故选C.
B、铅蓄电池放电过程中,正极上二氧化铅转化为硫酸铅,负极上铅单质转化为硫酸铅,两极质量均增加,故B错误;
C、在NH3?H2O稀溶液中,
| c(H+)?c(NH3?H2O) | ||
c(N
|
| c(OH-)?c(H+) | ||
|
| Kw |
| Ka |
| c(H+)?c(NH3?H2O) | ||
c(N
|
D、在NaHS溶液中,滴入少量CuCl2溶液,HS-电离出的S2-与Cu2+结合生成CuS沉淀,HS-电离程度增大,pH减小,故D错误;
故选C.
点评:本题考查了反应自发进行的判断依据、原电池反应特征、弱电解质的电离、Ka和Kw的影响因素等,注意把握电离平衡影响因素分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列各示意图与对应的表述正确的是( )
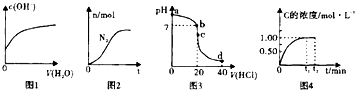

| A、图1表示亚硫酸氢钠溶液加水稀释时,溶液中c(OH-)的变化[已知亚硫酸氢钠溶液c(SO32-)>c(H2SO3)] |
| B、图2表示某离子反应中涉及Cl-,H+,N2,ClO-,NH4-,H2O六种微粒,其中N2的物质的量随时间变化的曲线,反应后溶液的酸性明显减弱 |
| C、图3表示室温下,将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线,d点所示溶中离子浓度由大到小的排序是c(Cl+)>c(NH4+)>c(H+)>c(OH+) |
| D、图4表示均为1molA,B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),C的浓度随时间变化的曲线,则x=2 |
下列离子不会对水体造成污染的是( )
| A、Ba2+ |
| B、Cl- |
| C、Cu2+ |
| D、Pb2+ |
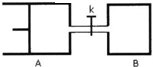 如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
| D、打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计) |
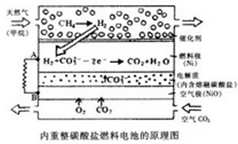 以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )| A、该电池将热能转化为电能 |
| B、外电子流动方向:由B流向A |
| C、空气极发生电极反应式为:O2+4c-+2CO2=2CO32- |
| D、以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
下列物质中既含有共价键又含离子键的化合物是( )
| A、NaCl |
| B、Al2O3 |
| C、NaOH |
| D、C6H6 |
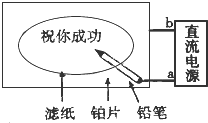 某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列
某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列