题目内容
下列关于物质的量浓度表述正确的是( )
| A、0.3mol?L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol |
| B、当1L水吸收22.4L(标准状况)氨气时所得氨水的浓度是1mol?L-1 |
| C、在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 |
| D、10℃的0.35mol?L-1的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时过滤,其滤液中溶质的物质的量浓度仍为0.35mol?L-1 |
考点:物质的量浓度的相关计算
专题:
分析:A.溶液体积未知,不能计算离子物质的量;
B.体积1L应是溶液体积,不是溶剂水的体积;
C.根据电荷守恒判断;
D.KCl饱和溶液100mL,蒸发掉5g水,冷却到原来温度,剩余溶液仍是饱和溶液,溶液浓度不变.
B.体积1L应是溶液体积,不是溶剂水的体积;
C.根据电荷守恒判断;
D.KCl饱和溶液100mL,蒸发掉5g水,冷却到原来温度,剩余溶液仍是饱和溶液,溶液浓度不变.
解答:
解:A.硫酸钠溶液物质的量浓度已知,但溶液体积未知,不能计算离子物质的量,故A错误;
B.标况下22.4L氨气为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,体积1L应是溶液体积,不是溶剂水的体积,故B错误;
C.根据电荷守恒,溶液中c(Na+)+c(K+)=2c(SO42-)+c(Cl-),Na+和SO42-的物质的量浓度相等,则c(K+)>c(Cl-),故C错误;
D.KCl饱和溶液100mL,蒸发掉5g水,冷却到原来温度,剩余溶液仍是饱和溶液,溶液浓度不变仍为0.35mol?L-1,故D正确,
故选D.
B.标况下22.4L氨气为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,体积1L应是溶液体积,不是溶剂水的体积,故B错误;
C.根据电荷守恒,溶液中c(Na+)+c(K+)=2c(SO42-)+c(Cl-),Na+和SO42-的物质的量浓度相等,则c(K+)>c(Cl-),故C错误;
D.KCl饱和溶液100mL,蒸发掉5g水,冷却到原来温度,剩余溶液仍是饱和溶液,溶液浓度不变仍为0.35mol?L-1,故D正确,
故选D.
点评:本题考查物质的量浓度,难度不大,注意C选项利用电荷守恒判断,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
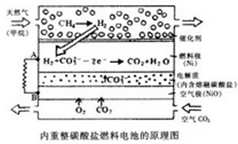 以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )| A、该电池将热能转化为电能 |
| B、外电子流动方向:由B流向A |
| C、空气极发生电极反应式为:O2+4c-+2CO2=2CO32- |
| D、以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
下列叙述正确的是( )
| A、1molH2燃烧放出的热量为H2的燃烧热 |
| B、pH=4的醋酸溶液中,c(CH3COOH)=0.1mol?L-1 |
| C、在NaS溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D、NaCl和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
下列物质中既含有共价键又含离子键的化合物是( )
| A、NaCl |
| B、Al2O3 |
| C、NaOH |
| D、C6H6 |
下列说法正确的是( )
| A、在标准状况下,1mol水和1mol氢气的体积都为22.4L |
| B、2g氢气和44g二氧化碳的体积相等 |
| C、1mol某气体的体积为22.4L,则该气体一定处于标准状况 |
| D、在标准状况下,0.5NA个氨气分子所占的体积为11.2L |
NA为阿佛伽德罗常数,下列说法正确的是( )
| A、1L1.0mol?L-1的NaAlO2的水溶液中含氧原子个数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有的0H-数目为0.1NA |
| D、0.1mol基和0.1mol氢氧根离子所含电子数均为0.9NA |
在下列物质分类中,前者包括后者的是( )
| A、氧化物 化合物 |
| B、溶液 分散系 |
| C、溶液 胶体 |
| D、化合物 电解质 |
 若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为