题目内容
X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
(1)Y位于元素周期表第 周期第 族;Y和Z的氢化物稳定性顺序为: > (写化学式).
(2)X、Y、Z的第一电离能由大到小的顺序为 ;W的基态原子核外电子排布式是
(3)向W单质与盐酸反应后的溶液中通入过量Y的气态氢化物,能观察到的现象是 ,发生反应的化学方程式是 .
(4)已知Y的氢化物在催化加热的条件下,可以与Z2发生氧化还原反应,并且在室温下每转移10mol电子放热akJ,该反应的热化学方程式是 .
| 元素 | 相关信息 |
| X | X的一种单质是自然界硬度最大的晶体 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+1 |
| Z | Z的基态原子L层电子数是K层电子数的3倍 |
| W | W的一种核素的质量数为58,中子数为32 |
(2)X、Y、Z的第一电离能由大到小的顺序为
(3)向W单质与盐酸反应后的溶液中通入过量Y的气态氢化物,能观察到的现象是
(4)已知Y的氢化物在催化加热的条件下,可以与Z2发生氧化还原反应,并且在室温下每转移10mol电子放热akJ,该反应的热化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,X的一种单质是自然界硬度最大的晶体,则X为碳元素,Y的基态原子最外层电子排布式为nsnnpn+1,则n=2,Y为氮元素,Z的基态原子L层电子数是K层电子数的3倍,则Z为氧元素,W的一种核素的质量数为58,中子数为32,则W为铁元素,据此答题.
解答:
解:X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,X的一种单质是自然界硬度最大的晶体,则X为碳元素,Y的基态原子最外层电子排布式为nsnnpn+1,则n=2,Y为氮元素,Z的基态原子L层电子数是K层电子数的3倍,则Z为氧元素,W的一种核素的质量数为58,中子数为32,则W为铁元素,
(1)Y为氮元素,位于元素周期表第二周期第VA族;因为氧的非金属性强于氮,所以Y和Z的氢化物稳定性顺序为:H2O>NH3,
故答案为:二; VA; H2O; NH3.
(2)由于氮原子的最外层p轨道电子处于半满状态,是一种稳定结构,所以氮的第一电离能高于相邻同周期元素,其它主族元素非金属性越强,第一电离能越大,所以X、Y、Z的第一电离能由大到小的顺序为N>O>C;W为铁元素,它的基态原子核外电子排布式是1s22s22p63s23p63d64s2(或[Ar]3d64s2),
故答案为:N>O>C; 1s22s22p63s23p63d64s2(或[Ar]3d64s2).
(3)铁与盐酸反应生成氯化亚铁的溶液,再向其中通入过量氨气,生成氢氧化亚铁,后被空气中的氧气氧化生成氢氧化铁,所以观察到的现象是先出现白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,发生反应的化学方程式是FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先出现白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色;FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)已知氨气在催化加热的条件下,可以与O2发生氧化还原反应,方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(l),反应中每4mol氨气反应转移20mol电子,所以每转移10mol电子即有2mol氨气参加反应,放热akJ,所以反应的热化学方程式是4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-2akJ?mol-1,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-2akJ?mol-1.
(1)Y为氮元素,位于元素周期表第二周期第VA族;因为氧的非金属性强于氮,所以Y和Z的氢化物稳定性顺序为:H2O>NH3,
故答案为:二; VA; H2O; NH3.
(2)由于氮原子的最外层p轨道电子处于半满状态,是一种稳定结构,所以氮的第一电离能高于相邻同周期元素,其它主族元素非金属性越强,第一电离能越大,所以X、Y、Z的第一电离能由大到小的顺序为N>O>C;W为铁元素,它的基态原子核外电子排布式是1s22s22p63s23p63d64s2(或[Ar]3d64s2),
故答案为:N>O>C; 1s22s22p63s23p63d64s2(或[Ar]3d64s2).
(3)铁与盐酸反应生成氯化亚铁的溶液,再向其中通入过量氨气,生成氢氧化亚铁,后被空气中的氧气氧化生成氢氧化铁,所以观察到的现象是先出现白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,发生反应的化学方程式是FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先出现白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色;FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)已知氨气在催化加热的条件下,可以与O2发生氧化还原反应,方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(l),反应中每4mol氨气反应转移20mol电子,所以每转移10mol电子即有2mol氨气参加反应,放热akJ,所以反应的热化学方程式是4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-2akJ?mol-1,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-2akJ?mol-1.
点评:本题主要考查了元素周期表、元素周期律、原子核外电子排布、氧化还原反应、热化学方程式等知识点,中等难度,解题的关键是元素推断,答题时注意化学用语的正确表达.

练习册系列答案
相关题目
有关化学化学平衡状态的特征,下列说法正确的是( )
| A、所有的化学反应都存在化学平衡状态 |
| B、平衡时反应已经达到最大限度,反应停止了 |
| C、平衡时各组分的浓度相等 |
| D、化学平衡状态是一种动态平衡 |
下列离子不会对水体造成污染的是( )
| A、Ba2+ |
| B、Cl- |
| C、Cu2+ |
| D、Pb2+ |
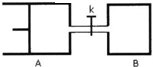 如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
| D、打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计) |
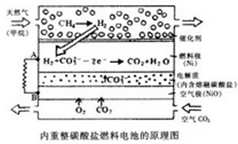 以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )| A、该电池将热能转化为电能 |
| B、外电子流动方向:由B流向A |
| C、空气极发生电极反应式为:O2+4c-+2CO2=2CO32- |
| D、以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
NA为阿佛伽德罗常数,下列说法正确的是( )
| A、1L1.0mol?L-1的NaAlO2的水溶液中含氧原子个数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有的0H-数目为0.1NA |
| D、0.1mol基和0.1mol氢氧根离子所含电子数均为0.9NA |
 若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为