题目内容
6.根据下列实验现象所得出的结论不正确的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO3 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热. | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂;
B.氨气能使湿润的红色石蕊试纸变蓝色;
C.酚酞遇碱变红色,溶液的碱性越强,加入酚酞后颜色越深;
D.溶度积常数表达式相同时,溶度积常数大的物质能转化为溶度积常数小的物质.
解答 解:A.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂,说明氧化性:Cl2<KBrO3,故A错误;
B.氨气能使湿润的红色石蕊试纸变蓝色,KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变蓝色,说明NO3-还原为NH3,故B正确;
C.酚酞遇碱变红色,溶液的碱性越强,加入酚酞后颜色越深,向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热,红色加深,说明溶液碱性增强,则促进碳酸根离子水解,所以盐类水解是吸热反应,故C正确;
D.溶度积常数表达式相同时,溶度积常数大的物质能转化为溶度积常数小的物质,0.1mol•L-1的MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液,白色沉淀逐渐变为蓝色沉淀,则说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2],故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化性强弱比较、盐类水解、难溶物的转化等知识点,明确实验原理、物质性质是解本题关键,侧重考查学生实验观察分析及评价能力,易错选项是A.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
17.1-丙醇的蒸气和空气混合,通过灼热的铜网生成一种新的化合物.下列物质中,和该化合物互为同分异构体的是( )
| A. | CH3CH2CHO | B. | CH3CH2COOH | C. | CH3COCH3 | D. | CH3CH2OCH3 |
14. 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
(1)CO的检测.
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应转移电子数为0.1NA.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图1所示,这种传感器利用了燃料电池原理.则该电池的负极反应式为CO+H2O-2e-=CO2+2H+.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
①上述反应T1℃时的平衡常数为K=$\frac{9}{16}$.
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理为NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O,△<0在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$、不同温度对脱氨率的影响如图2所示.请回答温度对脱氨率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大,给出合理的解释300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(4)硫酸厂尾气中的SO2可催化氧化生成SO3,再合成硫酸.在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍.
 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.(1)CO的检测.
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应转移电子数为0.1NA.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图1所示,这种传感器利用了燃料电池原理.则该电池的负极反应式为CO+H2O-2e-=CO2+2H+.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理为NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O,△<0在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$、不同温度对脱氨率的影响如图2所示.请回答温度对脱氨率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大,给出合理的解释300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(4)硫酸厂尾气中的SO2可催化氧化生成SO3,再合成硫酸.在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍.
1.有关下列图象的说法不正确的是( )
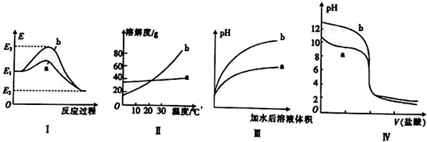

| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |
11.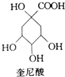 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )
 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图所示,下列有关奎尼酸的说法中错误的是( )| A. | 分子式为C7H12O6 | B. | 不能发生加成反应 | ||
| C. | 能与乙醇发生酯化反应 | D. | 1mol奎尼酸最多能消耗6molNaOH |
15.下列试剂能区分苯酚、甲酸、乙酸乙酯、甲醇的是( )
| A. | NaOH溶液 | B. | FeCl3溶液 | C. | 溴水 | D. | 银氨溶液 |
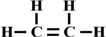 ,空间结构是平面型分子;
,空间结构是平面型分子; ) ⑤乙醇(C2H5OH)与甲醚(CH3-O-CH3)⑥
) ⑤乙醇(C2H5OH)与甲醚(CH3-O-CH3)⑥ 和
和
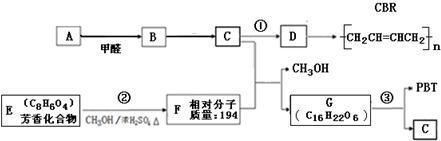
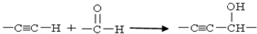
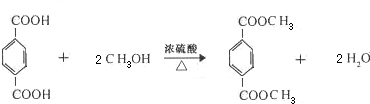 .E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是
.E有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢谱显示3个吸收峰,且峰面积之比为1:1:1的结构简式是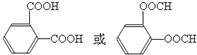 .
.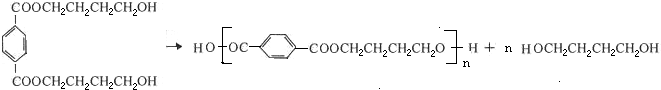 .
.