题目内容
11.(1)若某药品质量约为32.0g,托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.| 50g | 20g | 20g | 10g | 5g |
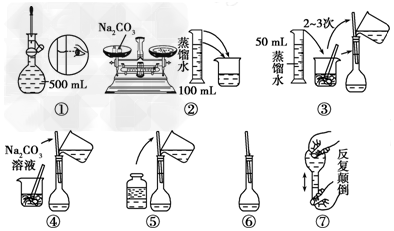
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响.
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度偏低
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度偏高
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度无影响.
分析 (1)根据先加质量大的砝码,再换小砝码,最后使用游码的原则完成;
(2)根据500mL 0.1mol/L Na2CO3溶液含有的碳酸钠的物质的量计算出碳酸钠的质量;根据配制一定物质的量浓度的溶液的步骤进行排序;
(3)根据实验操作对c=$\frac{n}{V}$产生的影响进行分析.
解答 解:(1)某药品质量约为32g,用托盘天平准确称其质量,先在右盘加入50g砝码,质量过大,表示为:50g↓↑;然后换20g砝码,砝码质量不足,表示为:20g↓;再加20g砝码,20g砝码质量过大,表示为:↓↑;换10g砝码,10g砝码质量不足,表示为:10g↓;再加5g砝码,5g砝码质量过大,拿下5g砝码,表示为:5g↓↑;最后移动游码到2g进行调平,
故答案为:
| 50g | 20g | 20g | 10g | 5g |
| ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以实验时图中所示操作的先后顺序为:②④③⑤①⑥,
故答案为:5.3;②④③⑤①⑥;
(3)①用量筒取液态溶质,读数时俯视量筒会使所量取液体体积比理论值小,使所配制溶液的浓度偏低,故答案为:偏低;
②用量筒量取液体时已经排除残留的部分,故用水洗涤,洗涤液倒入容量瓶,液态溶质偏多,使所配溶液的浓度偏高,故答案为:偏高;
③定容摇匀后,即使有少量溶液外流,对所配制溶液的浓度是没有影响,故答案为:无影响.
点评 本题考查了配制一定物质的量浓度的溶液步骤及误差分析,题目难度不大,注意熟练掌握配制一定物质的量浓度的溶液的方法,多积累误差分析的方法和技巧.

练习册系列答案
相关题目
2.下列叙述不正确的是( )
| A. | 对于C(s)+H2O(g)?CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 | |
| B. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 | |
| C. | 对于C(s)+CO2(g)?2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 | |
| D. | 对于I2(g)+H2(g)?2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 |
19.在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.85倍.下列叙述中错误的是( )
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
16.下列离子反应方程式,书写正确的是( )
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
3.下列分类或归类正确的是( )
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质
④火碱、纯碱、碳酸钙都是电解质
⑤碘酒、淀粉、水雾、纳米材料均为胶体.
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质
④火碱、纯碱、碳酸钙都是电解质
⑤碘酒、淀粉、水雾、纳米材料均为胶体.
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ②③④⑤ |
20.对于平衡体系:mA(g)+nB(g)?pC(g)+qD(g),下列判断正确的是( )
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q | |
| B. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| C. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: