题目内容
3.下列分类或归类正确的是( )①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质
④火碱、纯碱、碳酸钙都是电解质
⑤碘酒、淀粉、水雾、纳米材料均为胶体.
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ②③④⑤ |
分析 ①由同种物质组成的为纯净物,包括单质和化合物;
②单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物;
③在水溶液里或熔融状态下完全电离的是强电解质,部分电离的是弱电解质;
④水溶液中或熔融状态下导电的化合物为电解质;
⑤胶体的本质特征是分散质微粒直径在1nm-100nm间.
解答 解:①氨水是氨气的水溶液,属于混合物,故①错误;
②CaCl2、NaOH、HCl、IBr是由不同种元素组成的纯净物,属于化合物,故②正确;
③水银的单质,不是电解质,故③错误;
④火碱、纯碱水溶液中导电、碳酸钙熔融状态下导电都是电解质,故④正确;
⑤碘酒是碘单质的酒精溶液,淀粉、纳米材料不是分散系,胶体是分散系,故⑤错误;
故选C.
点评 本题考查了化学基本概念的理解和应用,熟悉混合物、化合物、单质、化合物、电解质、非电解质等概念的分析即可判断,掌握物质的组成是解题关键.

练习册系列答案
相关题目
14.同温同压下,下列各组热化学方程式中,△H1<△H2的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 | |
| D. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 |
11.(1)若某药品质量约为32.0g,托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.
(2)配制500mL 0.1mol•L-1 Na2CO3溶液,图中操作②中应该填写的数据为5.3,实验操作的先后顺序为②④③⑤①⑥ (填编号).
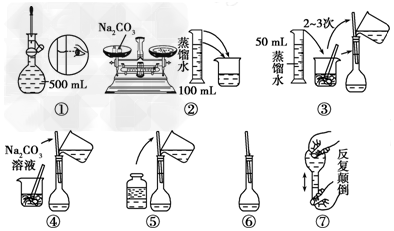
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响.
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度偏低
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度偏高
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度无影响.
| 50g | 20g | 20g | 10g | 5g |

(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响.
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度偏低
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度偏高
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度无影响.
18.在某温度下,可逆反应mA+nB?pC+qD的平衡常数为K,下列说法正确的是( )
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K越小,达到平衡时,反应物的转化率越大 | |
| C. | K随反应物浓度的改变而改变 | |
| D. | K随温度和压强的改变而改变 |
8.相同温度下,体积相同的两个容器中,充入等质量CO2和CO气体,下列判断正确的是( )
| A. | CO2和CO对容器产生的压强之比是7:11 | |
| B. | CO2和CO的密度之比是11:7 | |
| C. | CO2和CO的分子数相等 | |
| D. | CO2和CO的氧原子个数比是22:7 |
15.将35.0g锌粉与少量浓硫酸在加热的条件充分反应,共收集到混合气体11.2L(标准状况),则过量的锌粉的质量为( )
| A. | 1.0g | B. | 2.0g | C. | 2.5g | D. | 3.5g |
12.已知25℃时,有关弱酸的电离平衡常数如表:
下列有关说法正确的是( )
| 化学式 | CH3COOH | HCN |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 |
| A. | 体积和pH相同的CH3COOH溶液与HCN溶液,分别与足量的Fe反应,HCN溶液产生的H2更多 | |
| B. | 体积和pH相同的CH3COOH溶液与HCN溶液,中和NaOH溶液所消耗NaOH的物质的量相同 | |
| C. | amol•L-1HCN溶液加水稀释后,电离平衡常数减小,加入KCN晶体后,电离平衡常数增大 | |
| D. | 25℃时,在等浓度的CH3COOH溶液与HCN溶液中,水的电离程度前者大 |
13.下列事实可用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 加入催化剂有利于氨催化氧化的反应 |
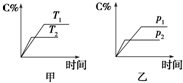 可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题:
可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题: