题目内容
6..A、B、C、D、E是中学化学常见单质,X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):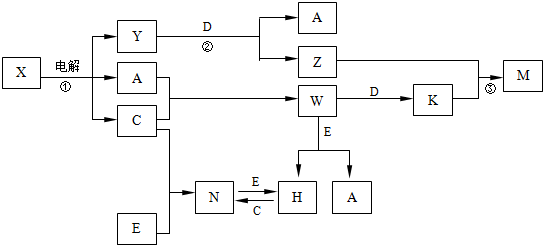
(1)Y的电子式为
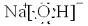 ,构成C单质的元素在周期表中位于第三周期第VIIA族
,构成C单质的元素在周期表中位于第三周期第VIIA族(2)反应①的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑反应②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)某工厂用B制漂白粉.
①写出制漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:2I-+ClO-+2H+=I2+Cl-+H2O
静置.待完全反应后,用0.1mol•L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL.则该漂白粉中有效成分的质量分数为35.75%(保留到小数点后两位).
分析 A、B、C、D、E是中学化学常见单质,依据题中的转化关系,X$\stackrel{电解}{→}$A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;
(3)ClO-具有强氧化性,酸性条件下,将I-氧化为I2,自身被还有为Cl-,同时生成H2O,发生离子反应为:2I-+ClO-+2H+=I2+Cl-+H2O,结合2Na2S2O3+I2=Na2S4O6+2NaI,可得关系式Ca(ClO)2~2I2~4Na2S2O3,据此计算n[Ca(ClO)2],根据m=nM计算次氯酸钙的质量,进而计算次氯酸钙的质量分数.
解答 解:A、B、C、D、E是中学化学常见单质,依据题中的转化关系,X$\stackrel{电解}{→}$A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;
综上所述转化关系中的物质分别是:A、H2;B、Na;C、Cl2;D、Al;E、Fe;H、FeCl2;K、AlCl3;M、Al(OH)3;N、FeCl3;W、HCl;X、NaCl;Y、NaOH;Z、NaAlO2;
(1)Y为NaOH,是离子化合物,电子式为: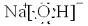 ,C为Cl2,构成C单质的元素在周期表中位于第三周期第VIIA族,故答案为:
,C为Cl2,构成C单质的元素在周期表中位于第三周期第VIIA族,故答案为: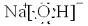 ;第三周期第VIIA族;
;第三周期第VIIA族;
(2)根据以上分析,反应①的离子方程式为2Cl-+2 H2O $\frac{\underline{\;通电\;}}{\;}$ 2OH-+Cl2↑+H2↑;反应②的离子方程式为2Al+2OH-+2 H2O=2AlO2-+3H2↑;
故答案为:2Cl-+2 H2O $\frac{\underline{\;通电\;}}{\;}$ 2OH-+Cl2↑+H2↑;2Al+2OH-+2 H2O=2AlO2-+3H2↑;
(3)①制漂白粉为氯气与氢氧化钙反应,化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②加入过量的KI溶液和过量的硫酸与漂白粉溶液,发生离子反应为:2I-+ClO-+2H+=I2+Cl-+H2O,由2Na2S2O3+I2=Na2S4O6+2NaI,可得关系式Ca(ClO)2~2I2~4Na2S2O3,n[Ca(ClO)2]=$\frac{1}{4}$n(Na2S2O3)=20.0 mL×10-3 L•mL-1×0.1 mol•L-1×$\frac{250mL}{25mL}$=0.005 mol,
Ca(ClO)2%=$\frac{0.005mol×143g/mol}{2.0g}$×100%=35.75%,
故答案为:2I-+ClO-+2H+=I2+Cl-+H2O;35.75%.
点评 本题考查了元素化合物的物质推断,主要考查饱和食盐水的电解产物的分析判断,铝及其化合物、氧化还原反应滴定计算,注意利用关系式进行计算,综合性较强,难度较大.

| A. | HCl、H2SO4、S | B. | 金刚石、Na3PO4、Mg | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液,洗气 |
| B | 溴苯 | 溴 | NaOH溶液,分液 |
| C | 乙酸 | 乙醇 | 金属钠,蒸馏 |
| D | 乙醇 | 水 | 生石灰,过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O. | |
| B. | 硝酸银溶液和过量的氨水反应:Ag++3NH3•H2O═Ag(NH3)2OH+NH4++2H2O | |
| C. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 碳酸钠溶液中加入过量苯酚: +CO32-→ +CO32-→ +HCO3- +HCO3- |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(2)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(3)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 地球上99%的溴蕴藏在大海中,故溴被称为“海洋元素” | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、K+、I-、Cl- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | K+、Cu2+、Br-、OH- |
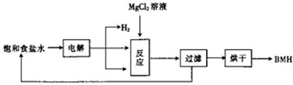 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.