题目内容
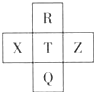 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A、非金属性:Z<T<X |
| B、R与Q原子核外电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:X>T |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,由元素R、X、T、Z、Q在元素周期表中的相对位置可知,T为Cl、Q为Br、X为S、Z为Ar,结合元素周期律解答.
解答:
解:R单质在暗处与H2剧烈化合并发生爆炸,则R为F元素,由元素R、X、T、Z、Q在元素周期表中的相对位置可知,T为Cl、Q为Br、X为S、Z为Ar,
A.同周期随原子序数增大,主族元素非金属性增强,Z为稀有气体Ar,化学性质稳定,故非金属性Ar<S<cl,故A错误;
B.R为F、Q为Br,二者原子核外电子数相差8+18=26,故B正确;
C.同主族自上而下非金属性减弱,氢化物稳定性减弱,故C错误;
D.非金属性X<T,故最高价氧化物的水化物的酸性:X<T,故D错误,
故选B.
A.同周期随原子序数增大,主族元素非金属性增强,Z为稀有气体Ar,化学性质稳定,故非金属性Ar<S<cl,故A错误;
B.R为F、Q为Br,二者原子核外电子数相差8+18=26,故B正确;
C.同主族自上而下非金属性减弱,氢化物稳定性减弱,故C错误;
D.非金属性X<T,故最高价氧化物的水化物的酸性:X<T,故D错误,
故选B.
点评:本题考查元素周期表与元素周期律应用,难度不大,注意对元素周期律的理解掌握,理解同主族原子序数关系.

练习册系列答案
相关题目
下列化学用语的表达,正确的是( )
| A、氮气的电子式:N??N |
| B、乙烯的结构简式:CH2CH2 |
| C、二氧化碳分子的结构式:O-C-O |
D、CH4分子的球棍模型: |
下列叙述错误的是( )
| A、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B、制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C、用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |
已知某溶液中Cl-、Br-、I-的离子数之比为1:2:3,要使其溶液中的Cl-、Br-、I-的离子数之比变为1:1:1,则通入Cl2的分子数与原溶液中I-离子数之比为( )
| A、1:2 | B、1:3 |
| C、1:6 | D、3:1 |
下列有关金属的说法正确的是( )
| A、金属原子的核外电子在金属晶体中都是自由电子 |
| B、镁型和铜型的原子堆积方式空间利用率最高 |
| C、金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D、金属导电的实质是金属阳离子在外电场作用下的定向移动 |
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目减少 |
| B、再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
| C、溶液中c(OH-)增大 |
| D、醋酸的电离程度增大,c(H+)亦增大 |
已知还原性Fe2+>Br一,向100mLFeBr2溶液中通入标准状况下的C126.72L,C12全部被还原,测得溶液中c(Br-)=c(C1-),则原FeBr2溶液的物质的量浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、3 mol/L |
| D、4 mol/L |
